Fes-белок
Cтраница 1
 |
Железосеросодержащие ферменты эубактерий. [1] |
Остальные FeS-белки имеют более сложно организованные FeS-центры, в состав которых входит также неорганическая кислотолабильная сера. FeS-белки могут содержать один или более центров в молекуле. [2]
 |
Железосеросодержащие ферменты эубактерий. [3] |
Отличительная особенность FeS-белков - строение их активного центра, содержащего негемовое железо, связанное нековалентными связями с кислотолабильной серой и серой, входящей в состав цистеиновых остатков пептидной цепи. Разные типы железосероцентров ( FeS-центры) широко распространены в клетках. [4]
Среди переносчиков идентифицированы FeS-белки, менахинон и цитохромы типа Ь, однако перенос такого типа не связан с получением клеткой энергии. [5]
Часто в состав флавопротеидов входят FeS-белки - металлофла-вопротеиды. Кофакторную функцию рибофлавин выполняет в виде ФМН и ФАД. ФМН синтезируется из свободного рибофлавина при участии флавокиназы и АТФ. [6]
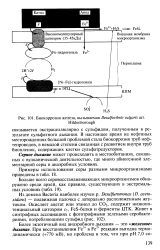 |
Биокоррозия железа, вызываемая Desulfovibrio vulgaris шт. [7] |
Окисляет ацетат или этанол до СО2, содержит низкопотенциальный цитохром с7, FeS-белки и ферменты ЦТК. [8]
НАДН-дегидрогеназа локализована во внутренней мембране митохондрий ( пересекает ее поперек) и имеет две простатические группы - ФМН и FeS-белки. В переносе двух атомов водорода участвует 6 7-диметилизоаллоксазин ( 1 - й и 10 - й атомы азота) ФМН. Далее FeS-белки забирают 2е -, а оставшиеся 2Н выталкиваются в межмембранное пространство и ждут момента, когда 2е - зарядят атом кислорода отрицательно, иными словами, на стадии НАДН-де - гидрогеназы разделяются потоки протонов и электронов. [9]
 |
Железосеросодержащие ферменты эубактерий. [10] |
Остальные FeS-белки имеют более сложно организованные FeS-центры, в состав которых входит также неорганическая кислотолабильная сера. FeS-белки могут содержать один или более центров в молекуле. [11]
С помощью этих ферментов электроны передаются в дыхательную цепь. В качестве компонентов электронтранспортной цепи идентифицированы FeS-белки ( ферредоксины, рубредоксин), флаводоксин, менахинон, цитохромы типа Ь, с. Особенностью дыхательной цепи многих сульфатвосстанавливающих эубактерий является высокое содержание низкопотенциального цитро-хрома с3 ( Е 0 - - 300 мВ), которому приписывают участие в акцептировании электронов с гидрогеназы. Все перечисленные выше соединения, вероятно, принимают участие в переносе электронов на SO -, но точная их последовательность и локализация на мембране не установлены. Получены данные, указывающие на то, что окисление Н2 происходит на наружной стороне мембраны, а реакция восстановления SO - - на внутренней. Из этого следует, что окисление Н2, сопряженное с восстановлением SO -, связано с трансмембранным окислительно-восстановительным процессом. Перенос электронов по дыхательной цепи сопровождается генерированием А 1н - На это указывает чувствительность процесса к веществам, повышающим проницаемость мембраны для протонов и делающим, таким образом, невозможным образование протонного градиента, а также к ингибиторам мембран-связанной протонной АТФ-синтазы. [12]
Дыхательная цепь тионовых бактерий содержит все типы переносчиков, характерных для аэробных хемогетеротрофов. У тионовых бактерий обнаружены флавоп-ротеины, убихиноны, FeS-белки, цитохромы типа Ь, с, цитохро-моксидазы о, d, a аъ. [13]
Дыхательные электронтранспортные цепи состоят из большого числа локализованных в мембране переносчиков, с помощью которых электроны передаются или вместе с протонами, т.е. в виде атомов водорода, или без них. Компонентами цепи, локализованными в мембране, являются переносчики белковой ( фла-вопротеины, FeS-белки, цитохромы) или небелковой ( хиноны) природы. Флавопротеины и хиноны осуществляют перенос атомов водорода, а FeS-белки и цитохромы - электронов. [14]
Супероксидные анионы генерируются при взаимодействии с молекулами 02 различных компонентов ( восстановленные флавины, хиноны, тиолы, FeS-белки), а также в реакциях, катализируемых рядом флавопротеиновых ферментов. Наконец, в процессе фотосинтеза имеет место поток электронов. [15]
Страницы: 1 2