G-белок
Cтраница 1
G-белок и G / F-белок), связывающего гуани -: новый иуклеотид и выполняющего регуляторную роль в сопряжении агонкст-рецепторпое взаимодействие - активация аденилатциклазы, и термолабильного каталитического белка - аденилатциклазы fSwillens S. [1]
 |
Трансмембранная передача информации с участием аденилатциклазы ( АС и ГТФ-связывающих белков. [2] |
Взаимодействие соответствующего G-белка с ферментом-усилителем сигнала приводит к изменению свойств фермента и соответственно к изменению его активности. [3]
 |
Трансмембранная передача информации с участием аденилатциклазы ( АС и ГТФ-связывающих белков. [4] |
Такая модификация прочно ассоциирует G-белки с мембранным бислоем. Следовательно, регуляторные белки функционируют в тесной связи с мембраной, и их свойства зависят от физико-химических характеристик мембраны. [5]
 |
Схематическое выражение центральной роли цАМФ и протеинкиназы в гормональной регуляции синтеза и распада гликогена. [6] |
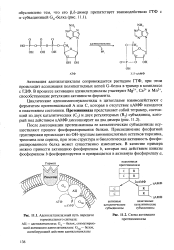
Адреналинрецепторный комплекс: АЦ - аденилатциклаза, G - G-белок; С и R - соответственно каталитические и регуляторные субъединицы протеинкиназы; КФ-киназа фосфорилазы Ь Ф - фосфорилаза; Глк-1 - Р - глюкозо-1 - фосфат; Глк-6 - Р - глюкозо-6 - фосфат; УДФ-Глк-ури-диндифосфатглюкоза; ГС - гликогенсинтаза. [7]
Активация аденилатциклазы сопровождается распадом ГТФ, при этом происходит ассоциация полипептидных цепей G-белка в тример в комплексе с ГДФ. В процессе активации аденилатциклазы участвуют Mg2, Ca2 и Мп2, способствующие регуляции активности фермента. [9]
Гормонрецепторный комплекс сообщает G-белку способность не только легко обменивать эндогенный связанный ГДФ на ГТФ, но и переводить Оз-белок в активированное состояние, при этом активный G-белок диссоциирует в присутствии ионов Mg2 на 3 -, у-субъединицы и комплекс а-субъединицы Gs в ГТФ-форме; этот активный комплекс затем перемещается к молекуле аденилатциклазы и активирует ее. [10]
Каталитический компонент аденилатциклазы, выделенный из разных тканей животных, представлен одним полипептидом с мол. G-белков он практически неактивен; содержит две SH-группы, одна из которых вовлечена в сопряжение с Оз-белком, а вторая необходима для проявления каталитической активности. В молекуле фермента имеется несколько аллостерических центров, через которые осуществляется регуляция активности низкомолекулярными соединениями: ионами Mg2, Mn2 и Са2, аденозином и форсколином. Под действием фосфоди-эстеразы цАМФ гидролизуется с образованием неактивного 5 - АМФ. [11]
Он представляет собой белки, связанные и с рецептором, и с аденилатциклазой. Фактически это два белка, имеющие сродство к ГТФ, поэтому их называют G-белки. В состоянии покоя тример G-белка ассоциирован с ГДФ. Молекулярные механизмы, связанные с трансляцией и усилением сигнала, заключаются в следующем. Гормон, взаимодействуя с рецептором, изменяет его конформацию, при этом происходит диссоциация комплекса G - белок - ГДФ. Кроме того, сам G-белок диссоциирует на р у-димер и а-субъединицу, к которой присоединяется ГТФ. Этот комплекс взаимодействует с сульфгидрильной группой аденилатциклазы и активирует данный фермент. Активная аденилатциклаза катализирует процесс синтеза цАМФ из АТФ. [12]
 |
Ковалентная модификация фермента путем фосфорилирования-дефосфо-рилирования остатков серина.| Нековалентная модификация фермента путем аденилирования-деадени-лирования. [13] |
Интересно, что дифтерийный и холерный токсины наделены энзиматической активностью, вызывая ДЦФ-рибозилирование ( соответственно инактивацию) ключевых клеточных ферментов или белков. Дифтерийный токсин выключает синтез белкового фактора 2 стадии элонгации синтеза белка, а холерный-специфического G-белка и как следствие вызывает массивную потерю воды. [14]
Рецептор состоит из трех компонентов: 1) функциональные группы молекул, которые на поверхности плазматической мембраны клетки обеспечивают взаимодействие гормона с рецептором; 2) связующие N - или G-белки. Во время передачи гормонального сигнала происходит сборка рецептора и усиление сигнала. Передача гормонального сигнала-возможна и без ГТФ, но он во много раз слабее. [15]
Страницы: 1 2