Гидроокись - редкоземельный элемент
Cтраница 1
Гидроокиси редкоземельных элементов - это наиболее сильные основания из всех гидроокисей трехвалентных элементов, исключая, быть может, актиний. Амфотерность для них ни в коей мере не характерна. Здесь опять уместно сопоставить свойства лантаноидов и d - элементов. У последних ионные радиусы с ростом заряда ядра уменьшаются довольно значительно, и это сказывается на увеличении амфотерности их гидроокисей. Большинство трехзаряд-ных ионов d - элементов входит в состав анионов. Между тем, трехвалентные ионы лантаноидов в обычных соединениях являются исключительно катионами. Это объясняется тем, что на всем протяжении от лантана до лютеция у них сохраняется относительно большой ионный радиус. Лишь у гидроокиси четырехвалентного церия в очень слабой степени проявляются и кислотные свойства. Например, некоторые соли цериевой кислоты ( цераты), в частности Na2Ce03, получены даже в твердом состоянии. В целом основность гидроокисей редкоземельных элементов убывает от лантана к лютецию. [1]
Гидроокиси редкоземельных элементов типа R ( OH) 3 по сравнению с гидроокисями всех других трехвалентных элементов обладают наиболее сильно выраженными основными свойствами. В этом смысле их можно поставить между Mg ( OH) 2 и А1 ( ОН) 3, однако основные их свойства, как уже отмечалось, по мере возрастания порядкового номера постепенно ослабевают. Получаются эти гидроокиси в виде студенистых аморфных осадков при добавлении к нагретым растворам соответствующих солей избытка NH4OH или NaOH. Они малорастворимы в воде, легко растворяются в кислотах. Наиболее сильным основанием является гидроокись лантана La ( OH) 3; гидроокись четырехвалентного церия Се ( ОН) 4 - более слабое основание, в щелочах не растворимое. Растворы солей этого основания подвергаются сильному гидролизу. [2]
Ввиду того, что гидроокиси редкоземельных элементов и иттрия осаждаются в интервале рН от 6 2 до 8 4 ( при 25) [62], а гидроокись тория - при рН, равном примерно 3 60, возможно их разделить не очень энергичными осадителями - гидроокисями и карбонатами металлов н органическими производными аммиака. [3]
Гидроокись тория, подобно гидроокисям редкоземельных элементов, нерастворима в растворах едких щелочей. Цирконий также встречается во многих редкоземельных минералах, и при определении редкоземельных металлов и тория во всех операциях следует учитывать его присутствие. Поэтому в процессе анализа цирконий удобно обрабатывать совместно с группой редкоземельных элементов, хотя он и не образует нерастворимого оксалата и фторида. В некоторых реакциях цирконий ведет себя подобно церию ( IV) и торию. [4]
Все степени наполнения более 0 5 при обработке щелочными растворами ацетата калия ( рН 10 - 13) заметным образом образуют гидроокись соответствующего редкоземельного элемента. При этом комплекс ( 172) распадается на анионный комплекс состава 1: 2 и упомянутую гидроокись. Такое диспропорционирование происходит и при действии гидроксильных ионов. [5]
Осадок оксалатов переносят в коническую колбу и нагревают с серной кислотой до полного разложения щавелевой кислоты; после охлаждения и разбавления осаждают гидроокиси редкоземельных элементов вливанием раствора в 10 % - ный раствор едкого натра. Промытый осадок растворяют в минимальном количестве разбавленной соляной кислоты с несколькими каплями перекиси водорода, избыток последней разрушают кипячением и осторожно нейтрализуют раствором карбоната натрия до образования лишь небольшого постоянного осадка. Затем добавляют 5 г тиосульфата натрия и кипятят для осаждения тория и скандия. Фильтрат обрабатывают едким натром и промытый осадок гидроокисей вновь растворяют в соляной кислоте; этот раствор выпаривают на водяной бане досуха, остаток растворяют в нескольких миллилитрах воды и добавляют 100 мл холодного насыщенного раствора сульфата алия и еще 5 г кристаллической соли. Белый или розовый осадок указывает на присутствие металлов цериевой группы; добавление щавелевой кислоты к фильтрату дает белый кристаллический осадок элементов иттриевой группы. [6]
При систематическом ходе анализа редкоземельные элементы и близко стоящий к ним по химическим свойствам иттрий осаждаются обычно аммиаком в виде гидроокисей совместно с железом, алюминием и другими металлами. Однако для количественного выделения гидроокисей редкоземельных элементов необходима сравнительно высокая величина рН раствора ( избыток аммиака), что резко снижает чистоту отделения от указанных двухвалентных металлов, в значительной степени загрязняющих осадок, а, кроме того, ведет к неполному осаждению таких металлов как алюминий, бериллий и галлий. [7]
При систематическом ходе анализа редкоземельные элементы и близко стоящий к ним по химическим свойствам иттрий осаждаются обычно аммиаком IB виде гидроокисей совместно с железом, алюминием и другими металлами. Однако для количественного выделения гидроокисей редкоземельных элементов необходима сравнительно высокая величина рН раствора ( избыток аммиака), что резко снижает чистоту отделения от указанных двухвалентных металлов, в значительной степени загрязняющих осадок, а, кроме того, ведет неполному осаждению таких металлов как алюминий, бериллий и галлий. [8]
Интересно отметить, что при рН в конце осаждения, равном 2 8, чистота церия с 99 % и более падает до 95 - 90 % и ниже. По-видимому, скорость растворения гидроокисей редкоземельных элементов при рН, равном 2 8, мала, и гидроокиси, выпадающие в областях пересыщения при введении осадителя, не успевают раствориться и загрязняют осадок. Этот кинетический механизм захвата должен быть широко распространен и заслуживает дальнейшего изучения ( наблюдался впервые С. [9]
После концентрирования сбросных растворов проводят осаждение гидроокиси железа при рН 2 3, которое достигается нейтрализацией аммиаком или мочевиной. Далее аммиаком ( без карбонатов) осаждают гидроокиси редкоземельных элементов. Из фильтрата с помощью Ма2СО3 осаждают карбонаты Щелочноземельных металлов. [10]
Так, щавелевая и плавиковая кислоты и их щелочные соли практически полностью осаждают редкоземельные элементы в виде их труднорастворп-мых оксалатов и фторидов. Гидроокиси редкоземельных элементов также обладают очень малой растворимостью. Их основной характер постепенно ослабевает с увеличением атомного номера элемента; это свойство широко применяется для их разделения. Сульфаты и карбонаты щелочных металлов служат для деления редкоземельных элементов на подгруппы, так как элементы Цср - группы1 в отличие от элементов Иттр-группы дают труднорастворимые двойные сульфаты п карбонаты щелочных металлов. [11]
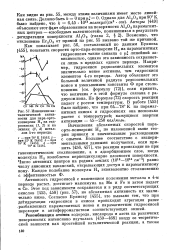 |
Изменение каталитической активности для пара-орто-конверсии Н2 на гидроокисях ( 1 2 ж на окисях ( 3, 4 металлов 4-го периода. [12] |
Возможно, что отклонение Ег203 от прямой на рис. 55 вызвано той же причиной. Как показывает рис. 56, составленный по данным Буянова [455], константа скорости орто-пара-конверсии Н2 на парамагнитных гидроокисях также связана с ц линейной зависимостью, однако эта зависимость сохраняется лишь в пределах одного периода. Например, гидроокиси редкоземельных элементов значительно менее активны, чем гидроокиси элементов 4-го периода. Автор объясняет это большой величиной радиуса редкоземельных ионов и уменьшением константы Ф при столкновении [ см. формулу ( 72) ], если принять, что величина г в этой формуле связана с радиусом иона. По формуле ( 72) скорость реакции падает с ростом температуры. В работе [455] было найдено, что при 64 - 78 К на Парамагнитных окисях и гидроокисях она несколько растет с температурой; кажущиеся энергии активации - 45 - 250 кал / моль. [13]
Природным источником получения обычно применяемого изотопа актиния Ас227 являются урановые руды, при обработке которых актиний осаждается в фракции редкоземельных элементов. Отделение его от редкоземельных элементов является нелегкой задачей. Вследствие чрезвычайно малой концентрации актиния всегда требуется предварительное обогащение этой фракции, обычно путем дробной кристаллизации магнийнитратного комплекса, аммонийнитратного комплекса или путем дробного осаждения оксалатов, фосфатов или гидроокисей редкоземельных элементов. Из обогащенного препарата актиний выделяют хроматографическим и экстракционным методами. [14]
Навеску тонкоистертой пробы приблизительно в 1 г помещали в платиновый тигель, где обрабатывали дважды смесью плавиковой и серной кислот. После фильтрования осаждали аммиаком гидроокиси редкоземельных элементов совместно о алюминием и железом. [15]
Страницы: 1 2