Химическая активность - элемент
Cтраница 1
Химическая активность элемента определяется способностью его атомов терять или приобретать электроны. [1]
Химическая активность элементов зависит не только от числа электронов на внешних энергетических уровнях атомов, но и от размеров атомов, формы электронных облаков, электронной плотности и степени симметрии расположения этих облаков. [2]
Как изменяется химическая активность элементов в ряду магний - барий. [3]
В зависимости от химической активности элемента отдача им электрона и обратный процесс - присоединение электронов к его положительно заряженному иону - осуществляется с различной легкостью. [4]
Последние величины иллюстрируют уменьшение химической активности элементов V, VI и VII групп и как следствие, рост неустойчивости ЭН3, ЭН2 и ЭН с увеличением порядкового номера Э; в то же время они свидетельствуют об усилении восстановительной активности соединений в этих вертикальных рядах. [5]
Последние величины иллюстрируют уменьшение химической активности элементов V, VI и VII. ЭН с увеличением порядкового номера Э; в то же время они свидетельствуют об усилении восстановительной активности соединений в этих вертикальных рядах. [6]
Легирование связано также с химической активностью элемента и упругостью его паров в условиях сварки. [7]
По мере заполнения электронами предвнешнего уровня химическая активность элементов понижается. Спаривание электронов на d - орбиталях уменьшает возможную максимальную степень окисления и увеличивает долю ковалентной составляющей связи. Вследствие лантаноидного сжатия у элементов, расположенных друг под другом, практически одинаковы атомные и ион-ные радиусы и наблюдается особая близость свойств. К концу триад наблюдается понижение устойчивых степеней окисления. Металлы в водных растворах не могут существовать в виде свободных ионов. [8]
Таким образом, здесь Н. Н. Бекетов близко подошел к представлениям об атомных радиусах и указал на их значение для характеристики химической активности элементов. [9]
Отсюда видно, что Н. Н. Бекетов весьма близко подошел к представлению об атомных радиусах и указал на их значение для характеристики химической активности элементов. [10]
Особенности сварочной технологии и возможность получения надежных в эксплуатации сварных соединений для различных служебных назначений определяются комплексом физико-механических свойств материалов, главнейшими из которых являются следующие: удельное электрическое сопротивление; теплопроводность; теплоемкость и скрытая теплота плавления; коэффициент теплового расширения; механические свойства при различных температурах; изменение структуры и свойств металла при различных видах термического воздействия на него; химическая активность элементов, входящих в состав свариваемого металла, в твердом и расплавленном состоянии. [11]
На воздухе медь покрывается рыхлым слоем основных карбонатов, серебро чернеет ( Ag2S) от наличия сероводорода, в то время как золото не изменяется. Химическая активность элементов в подгруппе меди сверху вниз падает. Об этом свидетельствуют также закономерно возрастающие положительные значения стандартных электродных потенциалов. [12]
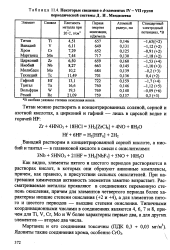 |
Некоторые сведения о / - элементах ГУ - VII групп периодической системы Д. И. Менделеева. [13] |
Как видно, элементы пятого и шестого периодов растворяются в растворах кислот, в которых они образуют анионные комплексы, причем, как правило, в присутствии сильных окислителей. При нагревании химическая активность элементов заметно возрастает. Рассматриваемые металлы проявляют в соединениях переменную степень окисления, причем для элементов четвертого периода более характерны низшие степени окисления ( 2 и 4), а для элементов пятого и шестого периодов - высшие степени окисления. Типичными координационными числами в соединениях являются 4, 6, 7 и 8, причем для Ti, V, Сг, Мо и W более характерны первые два, а для других элементов - вторые два числа. [14]
Подавляющее большинство элементов в природе находится в связанном состоянии - в виде соединений. При этом преобладающие формы соединений специфичны и определяются главным образом химической активностью элемента. Природные соединения, характерные для металлов, зависят от положения металлов в ряду активности: чем более активен металл, тем более ярко выраженный солеобразный характер имеют его соединения в природе. [15]
Страницы: 1 2 3