Антрадихинона
Cтраница 1
Антрадихиноны легко вовлекаются в разнообразные реакции присоединения. [1]
Антрадихиноны структуры XV и XVI обладают сильными окислительными свойствами и ярко выраженным ненасыщенным характером. [2]
Антрадихиноны структуры XV n XVI обладают сильными окислительными свойствами и ярко выраженным ненасыщенным характером. [3]
Оба антрадихинона при действии концентрированной серной кислоты мгновенно превращаются в пурпурин. [4]
Антрахиноны, фенантренхиноны и антрадихиноны этой реакции не дают. Нафтохинон дает окрашивание также с цианистым бензилом, хотя у последнего одна из двойной связей и входит в цикл. Флуорен, дифенилметан и инден не дают характерного окрашивания. [5]
При использовании двуокиси марганца в качестве окислителя часто получаются гидроксилированные антрадихиноны, к-рые затем восстанавливаются в полиоксиаитрахинопы сернистым ангидридом. [6]
При использовании двуокиси марганца в качестве окисли геля часто получаются гидроксили-ровапныо антрадихиноны, к-рые затем восстанавливаются в полиокс. [7]
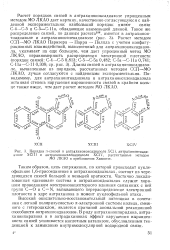 |
Порядки я-связей в антрахиноноксадиазоле ХСП, антрахинонтиади. [8] |
Высокий окислительно-восстановительный потенциал в сочетании с легкой поляризуемостью л-электронной системы кольца, смежного с гетероциклом, является причиной аномальной реакционной способности антрахинондиазолов. В ряду антрахинонпиридина, антра-хинонпиразина и в антрадихинонах эффект нарушения выравнен-ности связей усиливается кислотным катализом, обусловленным тенденцией к замыканию внутримолекулярной водородной связи. [9]
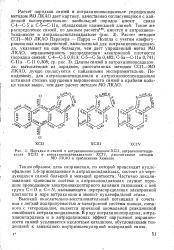 |
Порядки я-связей в антрахиноноксадиазоле ХСП, антрахинонтиади-азрле ХСШ и антрахинонселенадиазоле XCIV, рассчитанные методом МО ЛКАО в приближении Хюккеля. [10] |
Высокий окислительно-восстановительный потенциал в сочетании с легкой поляризуемостью л-электронной системы кольца, смежного с гетероциклом, является причиной аномальной реакционной способности антрахинондиазолов. В ряду антрахинонпиридина, антра-хинонпиразина и в антрадихинонах эффект нарушения выравненное связей усиливается кислотным катализом, обусловленным тенденцией к замыканию внутримолекулярной водородной связи. [11]
Хотя присоединение к антрахинону или его монозамещенным и находит применение, оно протекает с ограниченным числом реагентов и требует высоких-температур и давлений. В то же время ряд производных антрахинона может быть синтезирован в мягких условиях присоединением различных реагентов к антрадихинонам - соединениям, содержащим в антраценовом ядре две хиноидные группировки. [12]
Хотя присоединение к антрахинону или его монозамещенным и находит применение, оно протекает с ограниченным числом реагентов и требует высоких температур и давлений. В то же время ряд производных антрахинона может быть синтезирован в мягких условиях присоединением различных реагентов к антрадихинонам - соединениям, содержащим в антраценовом ядре две хиноидные группировки. [13]
Антрахинон и фенантренхинон по их свойствам и отношениям вполне сходны с соответствующими п-и о-хинонами нафталинового ряда. Так, фенантренхинон очень напоминает й-нафтохинон: он не пахнет, не летуч с парами воды; соединяется с 1 и 2 молекулами гидроксиламина, с синильной кислотой; восстанавливается сернистой кислотой. При энергичном окислении полиокси-замещенных антрахинонов возникают антрадихиноны; у них хинонные карбонилы заключаются попарно в разных ядрах. [14]
Таким образом путем обработки более низко гидроксилиро-ванных продуктов получают три -, тетра -, пента -, гексаоксиантра-хиноны, имеющие значение как красители. Температура при такой обработке бывает различной, от 25 - 30 и до 180, в зависимости от желаемой степени гидроксилирования и природы окисляемого продукта. Бывают процессы, кончающиеся образованием новых хиноидных циклов с переходом в антрадихиноны. [15]
Страницы: 1 2