Ib-подгруппа
Cтраница 1
Металлы IB-подгруппы мягки, имеют гранецентрированные кристаллические решетки, легко поддаются механической обработке, окрашены, обладают диамагнитными свойствами и высокой электрической проводимостью. [1]
Металлы IB-подгруппы при обычной температуре устойчивы к действию воздуха и воды. С водородом, углеродом и азотом они непосредственно не взаимодействуют. [2]
Все катионы IB-подгруппы образуют плохо растворимые в воде сульфиды, однако удобнее выделять их вначале в виде хлоридов. Это упрощает ход анализа и позволяет использовать общие для них групповые химико-аналитические свойства. Для отделения хлорида свинца от других хлоридов используется его сравнительно хорошая растворимость в горячей воде. [3]
Гидроксиды металлов IB-подгруппы получают действием на их соли растворов щелочей. Галогениды серебра ( за исключением AgF) мало растворимы в воде и используются в качестве светочувствительных материалов. [4]
Все металлы IB-подгруппы образуют комплексные соединения с анионами кислот, аммиаком или аминами в качестве лигандов. [5]
В химическом отношении металлы IB-подгруппы малоактивны. Восстановительная активность их нейтральных атомов понижается от меди к золоту; стандартные электродные потенциалы у них имеют положительные значения. Положительные ионы этих металлов легко восстанавливаются до нейтральных атомов. [6]
Разъясните, чем различаются элементы 1А - и IB-подгрупп. [7]
 |
Свойства металлов IIВ - подгруппы. [8] |
Предпоследний электронный уровень атомов цинка, кадмия ртути в отличие от атомов IB-подгруппы вполне стабилен и электронов не отдает. Поэтому в осуществлении химических связей участвуют только s - электроны внешнего уровня атомов этих элементов. [9]
Кроме того, в А-подгруппах периодической системы ( а также в IIB-подгруппе) температура плавления понижается с увеличением порядкового номера металла, а в В-подгруппах ( до IB-подгруппы), наоборот, растет. [10]
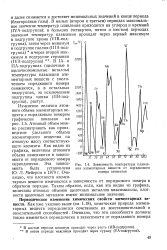 |
Зависимость температуры плавления элементарных веществ от порядкового номера элементов. [11] |
В IA - и ПА-подгруппах ( щелочные и щелочноземельные металлы) температуры плавления элементарных веществ с увеличением порядкового номера снижаются, а в остальных подгруппах, за исключением подгруппы цинка ( I IB-подгруппа), растут. [12]
Периодическая система элементов состоит из 8 групп, каждая из которых подразделена на главную и побочную подгруппы. Так, в главной подгруппе I группы ( IA-подгруппа) сосредоточены сходные по химическим свойствам щелочные металлы. Отличаются они между собой атомной массой, а следовательно, интенсивностью химических свойств: с увеличением атомной массы повышается их химическая активность. В побочной подгруппе ( IB-подгруппа) также находятся металлы, но они в противоположность щелочным металлам обладают низкой химической активностью. С увеличением атомной массы их активность падает. Так, медь Си легко реагирует с азотной кислотой НМОз, в то время как золото Аи с ней не взаимодействует. [13]
Страницы: 1