Iva-подгруппа
Cтраница 2
 |
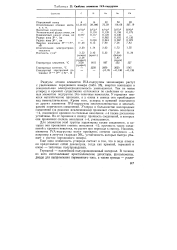
Схема энергетических полос и генезис полосы проводимости в нестехиометрических карбидах. [16] |
Таким образом, рост концентрации С-вакансий в монокарбидах переходных металлов IVa-подгруппы должен приводить к увеличению числа электронов в полосе проводимости и к повышению уровня Ферми в ней. Следовательно, представления о квазижесткой полосе для нестехиометрических монокарбидов с КВЭ 8 неприменимы. С другой стороны, увеличение дефектности неметаллической подрешетки должно на определенном этапе привести к тому, что появятся две ( или более) вакансий, разделенных лишь атомами металла. [17]
Различия в строении предвнеш-него электронного уровня у атомов фосфора и мышьяка меньше сказываются на изменении свойств элементов, чем при переходе от кремния к германию в IVA-подгруппе. У мышьяка сильнее выражены неметаллические свойства. У сурьмы неметаллические и металлические свойства проявляются приблизительно в одинаковой степени. Для висмута характерно преобладание металлических ( основных) свойств. [18]
Элементарные вещества и соединения некоторых р-элементов имеют большое значение для новой техники. Например, элементы IVA-подгруппы кремний и германий - полупроводники; широко применяется в промышленности алмаз. [19]
 |
Свойства элементов IVA-подгруппы. [20] |
Для элементов этой группы характерны также соединения, в которых они проявляют степень окисления 2; прочность таких соединений у кремния невелика, но растет при переходе к свинцу. Наконец, элементы IVA-подгруппы могут проявлять степени окисления - 4, например в летучих гидридах ЭН4, устойчивость которых быстро убывает с ростом порядкового номера. [21]
Оксиды ( IV) и соответствующие им гидроксиды остальных элементов IVA-подгруппы амфотерны. [22]
Си, Ag, Аи; Па-подгруппа цинка Zn, Cd, Hg; Ilia-подгруппа скандия Sc, Y, La, Ac; IVa-подгруппа титана Ti, Zr, Hf, Th; Va - подгруппа ванадия V, Nb, Та, Ра; Via-подгруппа хрома Cr, Mo, W; Vila - подгруппа марганца Mn, Ma, Re. VIII группа составлена тремя триадами: Fe, Co, Ni; Ru, Rh, Pd и Os, Ir, Pt; 4) наконец в системе имеем еще 14 металлов редких земель. [23]
Интерметаллические соединения представляют собой металло-подобные по внешнему виду и по физическим свойствам вещества. Однако типичные для металлов свойства у иктерметаллидов проявляются слабее: обычно их электрическая проводимость меньше, чем у компонента с наименьшей электрической проводимостью, а интсрметаллические соединения металлов IIIA - и IVA-подгрупп периодической системы даже являются полупроводниками. [24]
Начиная с IVa-подгрушш, вместо трех выделяются по четыре малых подгруппы. В первые из них попадают кайносимметричные / э-элементы 2-го периода, во вторые - элементы, образующие катионы с кайносимметричными электронами - / 7-элементы 3-го периода, в третьи - р-элементы шелл-аналоги 4-го и 5-го периодов, в четвертые - р-элементы 6-го периода, отличающиеся по своим свойствам из-за сложного строения столь многоэлектронных атомов. Поэтому в IVa-подгруппе выделяются следующие малые подгруппы: IVfl - С; 1Уя2 - Si; IVa3 - Ge и Sn; 1Уя4 - РЬ. [25]
При взаимодействии оксидов или гидроксидов германия ( IV), олова ( IV), свинца ( IV) со щелочами получают соли кислот типа Н2 [ Э ( ОН) в ] которые называют соответственно гексагидроксогерманатами, гек-сагидроксостаннатами и гексагидроксоплюмбатами. Подобно этому соли кислот типа Н2 [ Э ( ОН) 41 называют тетрагидроксогерманитами, тетрагидроксостаннитами и тетрагидроксоплюмбитами. Кислотные свойства соединений этих типов убывают от германия к свинцу. Вообще элементы IVA-подгруппы ( кроме углерода), благодаря вакатным d - орбиталям, проявляют свойства акцепторов, легко образуют многочисленные комплексные соединения обычно с координационным числом шесть. [26]
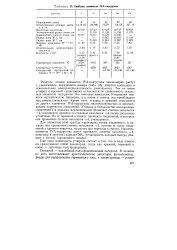 |
Свойства элементов IVA-подгруппы. [27] |
Радиусы атомов элементов IVA-подгруппы закономерно растут с увеличением порядкового номера ( табл. 25), энергия ионизации и относительная электроотрицательность уменьшаются. Тем не менее углерод и кремний существенно отличаются по свойствам от остальных элементов подгруппы. У германия имеются металлические признаки, а у олова и свинца они преобладают над неметаллическими. Кроме того, углерод и кремний отличаются от других элементов IVA-подгруппы многочисленностью и многообразием химических соединений. Углерод в большинстве кислородных соединений ( за редкими исключениями) проявляет степень окисления 4, соединения кремния со степенью окисления 4 также достаточно устойчивы. Но от германия к свинцу прочность соединений, в которых они проявляют степень окисления 4, уменьшается. [28]
Страницы: 1 2