Антрахинонпиридин
Cтраница 1
Антрахинонпиридины легко взаимодействуют и с другими нуклео-фильными реагентами, такими, как тиофенол. [1]
Антрахинонпиридины легко взаимодействуют и с другими нуклео-фильными реагентами, такими, как тиофенолы и амины107, для которых О-присоединение, естественно, невозможно. [2]
Для решения вопроса о значении в данном ряду эффекта хелатообразования, играющего важную роль в реакциях антрахинонпиридина и антрахинонпира-зина, необходимо располагать данными об устойчивости хелатных систем, которые могут возникнуть при протонировании гетероциклических хинонов. Подходящими моделями являются оксипроизвод-ные, где группа ОН включена в шестичленное кольцо за счет образования водородной связи с соответствующим гетероатомом. Сведения о хелатах такого типа с участием пиридинового и азинового атомов азота ограничиваются качественными наблюдениями. Известно, что такие вещества, как 10 - оксибензШхинолин172, 2 - ( пиридил-2) - ин-дандион-1 3173, 11-оксибенз [ а ] феназин112, из-за сильной водородной связи не растворяются в щелочах. Экспериментальные данные, которые позволили бы судить о водородной связи в 1 2 5-диазолах, в литературе отсутствуют. [3]
Для решения вопроса о значении в данном ряду эффекта хелатообразования, играющего важную роль в реакциях антрахинонпиридина и антрахинонпира-зина, необходимо располагать данными об устойчивости хелатных систем, которые могут возникнуть при протежировании гетероциклических хинонов. Подходящими моделями являются оксипроизвод-ные, где группа ОН включена в шестичленное кольцо за счет образования водородной связи с соответствующим гетероатомом. Сведения о хелатах такого типа с участием пиридинового и азинового атомов азота ограничиваются качественными наблюдениями. Известно, что такие вещества, как 10-оксибенз [ / г ] хинолин172, 2 - ( пиридил-2) ин-дандион-1 3173, 11-оксибенз [ а ] феназин112, из-за сильной водородной связи не растворяются в щелочах. Экспериментальные данные, которые позволили бы судить о водородной связи в 1 2 5-диазолах, в литературе отсутствуют. [4]
Проведенное сопоставление модельных соединений приводит к заключению, что тенденция к замыканию водородной связи в про-тонированной форме производных антрахинона должна убывать в последовательности: антрахинонпиридины антрахинонпирази-ны дихиноны - антрахинондиазолы. Для антрахинондиазолов, в отличие от остальных рассмотренных хигюпов, возникновение внутримолекулярной водородной связи не может играть существенной роли. [5]
Проведенное сопоставление модельных соединений приводит к заключению, что тенденция к замыканию водородной связи в про-гонированной форме производных антрахинона должна убывать в последовательности: антрахинонпиридины антрахинонпирази-ны дихиноны антрахинондиазолы. Для антрахинондиазолов, в отличие от остальных рассмотренных хинонов, возникновение внутримолекулярной водородной связи не может играть существенной роли. [6]
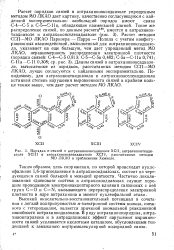 |
Порядки я-связей в антрахиноноксадиазоле ХСП, антрахинонтиади-азрле ХСШ и антрахинонселенадиазоле XCIV, рассчитанные методом МО ЛКАО в приближении Хюккеля. [7] |
Высокий окислительно-восстановительный потенциал в сочетании с легкой поляризуемостью л-электронной системы кольца, смежного с гетероциклом, является причиной аномальной реакционной способности антрахинондиазолов. В ряду антрахинонпиридина, антра-хинонпиразина и в антрадихинонах эффект нарушения выравненное связей усиливается кислотным катализом, обусловленным тенденцией к замыканию внутримолекулярной водородной связи. [8]
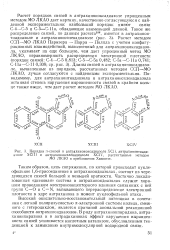 |
Порядки я-связей в антрахиноноксадиазоле ХСП, антрахинонтиади. [9] |
Высокий окислительно-восстановительный потенциал в сочетании с легкой поляризуемостью л-электронной системы кольца, смежного с гетероциклом, является причиной аномальной реакционной способности антрахинондиазолов. В ряду антрахинонпиридина, антра-хинонпиразина и в антрадихинонах эффект нарушения выравнен-ности связей усиливается кислотным катализом, обусловленным тенденцией к замыканию внутримолекулярной водородной связи. [10]
Страницы: 1