Карбонильная группа - ацетон
Cтраница 1
Карбонильная группа ацетона, несмотря на наличие в нем относительно активных атомов водорода в а-положении, менее склонна к присоединению, чем карбонильная группа ацетальдегида. Ацетон способен вступать в альдольную конденсацию, катализируемую осно-ьаниям, однако положение равновесия сильно сдвинуто в сторону исходного вещества. [1]
Протонирование кислорода карбонильной группы ацетона облегчает отрыв протона от СН3 - группы сопряженным основанием. [2]
 |
Электронное строение и схема энергетических уровней орбиталей. [3] |
Энергетические уровни относятся к карбонильной группе ацетона. [4]
 |
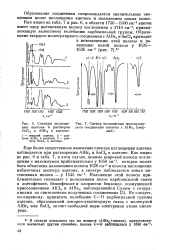
Спектр валентных колебаний СО ацетона, адсорбированного цеолитами NaX ( а и СаХ ( 6. [5] |
Положение полосы поглощения валентных колебаний карбонильных групп СО ацетона чувствительно к типу обменного катиона. Наиболее чувствительной к типу одновалентного катиона является средняя полоса поглощения. [6]
По изменению интенсивности и частоты колебания карбонильной группы ацетона при растворении его в диэтиловом эфире и диок-сане можно сделать вывод, что диоксан является более полярным растворителем. [7]
 |
Спектры поглоще - [ IMAGE ] Спектр поглощения молекуляр-ния ацетона и растворов ного соединения ацетона с А1Вг3 ( твердый. [8] |
Еще более существенное изменение спектра поглощения ацетона наблюдается при растворении А1Вг3 и SnCl4 в ацетоне. Ее следует, по-видимому, приписать колебанию С О карбонильной группы ацетона, образовавшей донорно-акцепторную связь с молекулой А1Вг3 или SnCl4 за счет свободной пары электронов атома кислорода. [9]
Карбанион образуется медленно и сразу же присоединяется к карбонильной группе второй молекулы ацетальдегида. Ацетон содержит больше дейтерия, так как карбанион присоединяется к карбонильной группе ацетона медленнее. Напряжение увеличивается в результате перехода атома углерода карбонильной группы из состояния гибридизации spz в sp3 на стадии присоединения. [10]
До сих пор не было предложено удовлетворительной количественной теории для объяснения изменений интенсивностей, вызванных влиянием природы растворителя, в особенности природы полярных растворителей. Например, валентное колебание карбонильной группы ацетона было исследовано в ряде растворителей, и было найдено, что интенсивность полосы значительно возрастает в полярных растворителях. Этот результат может быть объяснен с помощью простой модели, которая рассматривает взаимную поляризацию молекул растворителя и растворенного вещества. [11]
Имея достаточное число соединений с известной структурой, химик обычно может предсказать, при каких частотах будет поглощать излучение данная функциональная группа, находящаяся в соединении в определенном окружении. Если исключить влияние стери-ческих и электронных факторов на колебательные частоты, то одна и та же группа должна поглощать свет в инфракрасной области в очень узком интервале длин волн, независимо от строения молекулы, в которую она входит. Например, поглощение, отвечающее валентным колебаниям карбонильной группы ацетона, наблюдается при той же частоте, что и у ди-н-гексилкетона. [12]
Имея достаточное число соединений с известной структурой, химик обычно может предсказать, при каких частотах будет поглощать излучение данная функциональная группа, находящаяся в соединении в определенном окружении. Если исключить влияние стери-ческих и электронных факторов на колебательные частоты, то одна и та же группа должна поглощать свет в инфракрасной области Е очень узком интервале длин волн, независимо от строения молекулы, в которую она входит. Например, поглощение, отвечающее валентным колебаниям карбонильной группы ацетона, наблюдаете г при той же частоте, что и у дн-м-гексилкетона. [13]
Страницы: 1