Двуокись - никель
Cтраница 1
Двуокись никеля распределяется в кристаллической решетке NiOOH без образования новой структуры. В конечный период заряда наряду с окислением активного вещества на электроде наблюдается разряд гидроксильных ионов сопровождающийся выделением газообразного кислорода. [1]
Двуокись никеля Ni02 была также получена химическим путем. [2]
Двуокись никеля соединение настолько нестойкое, что говорить о ее практической ценности для технологии ферритов не приходится. [3]
Окись никеля Ni Og и двуокись никеля М Ог-сильные окислители, соляную кислоту окисляют до свободного хлора. [4]
Окись никеля, NLO, и двуокись никеля N O2 - сильные окислители, соляную кислоту окисляют до свободного хлора. [5]
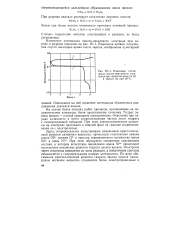 |
Изменение потенциала окисно-никелевого электрода при глубоком разряде ( 1 и заряде ( 2 при 20 С. [6] |
Отмеченное на ней снижение потенциала объяснялось разложением двуокиси никеля. [7]
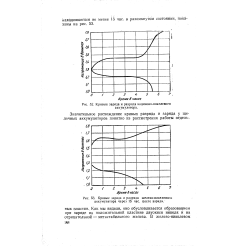 |
Кривые заряда и разряда кадмиево-никелевого аккумулятора.| Кривые заряда и разряда железо-никелевого, аккумулятора через 15 час. цосле заряда. [8] |
Как мы видели, оно обусловливается образованием при заряде на положительной пластине двуокиси никеля и на отрицательной - метастабильного железа. [9]
В первый период разряда наблюдается заметное уменьшение потенциала, что соответствует обеднению массы двуокисью никеля. Затем кривая делается почти горизонтальной. [10]
Саморазряд положительного электрода с заметной скоростью проходит в первый период после заряда вследствие разложения двуокиси никеля. Выделяющийся при этом кислород может окислять кадмий. [11]
Активный материал положительных пластин железо-никелевых щелочных аккумуляторов, например элемента Эдисона, непосредственно после зарядки состоит в основном из полуторной окиси никеля со значительным количеством двуокиси никеля. При обычных температурах двуокись никеля весьма нестабильна. Окислы никеля обладают высокими качествами для окислительного катализа. Наиболее распространенной и наиболее стабильной является окись никеля, легкость ее восстановления до металла в значительной мере зависит от условия образования. Сабатье утверждает, что многие окиси металлов, и среди них окись никеля, являются окисляющими катализаторами благодаря легкости восстановления их до металла или до низшего скисла окисляемой средой. Ипатьев [227] указывает, что окись никеля должна давать максимальную скорость гидрогенизации, так как она является окисью, богатой кислородом. Если при восстановлении окислов никеля водородом образуется1 не металлический никель, а низшие окислы, то последние ведут себя так же, как и восстановленный никель. Высушенная окись никеля легко адсорбирует влагу; предполагается, что гидраты окиси никеля могут иметь значение при реакциях восстановления и окисления окиси никеля. [12]
Никель образует следующие окислы: NiO-закись никеля [ окись никеля ( II) ] - зеленого цвета, NLO-окись никеля ( III) - серо-черного цвета и двуокись никеля NiO2 - черного дзета. [13]
Никель образует следующие окислы: NiO-закись никеля [ окись никеля ( II) ] - зеленого цвета, Ni2O3 - окись никеля ( III) - серо-черного цвета и двуокись никеля NiO2 - черного цвета. [14]
Активный материал положительных пластин железо-никелевых щелочных аккумуляторов, например элемента Эдисона, непосредственно после зарядки состоит в основном из полуторной окиси никеля со значительным количеством двуокиси никеля. При обычных температурах двуокись никеля весьма нестабильна. Окислы никеля обладают высокими качествами для окислительного катализа. Наиболее распространенной и наиболее стабильной является окись никеля, легкость ее восстановления до металла в значительной мере зависит от условия образования. Сабатье утверждает, что многие окиси металлов, и среди них окись никеля, являются окисляющими катализаторами благодаря легкости восстановления их до металла или до низшего скисла окисляемой средой. Ипатьев [227] указывает, что окись никеля должна давать максимальную скорость гидрогенизации, так как она является окисью, богатой кислородом. Если при восстановлении окислов никеля водородом образуется1 не металлический никель, а низшие окислы, то последние ведут себя так же, как и восстановленный никель. Высушенная окись никеля легко адсорбирует влагу; предполагается, что гидраты окиси никеля могут иметь значение при реакциях восстановления и окисления окиси никеля. [15]
Страницы: 1 2