Двуокись - уран
Cтраница 1
Двуокись урана образует твердые растворы со многими другими окислами металлов, в частности с окислами циркония, тория, ниобия и редкоземельных элементов. Она легко реагирует с кислородом. Имеются сообщения о пирофорности порошкообразной двуокиси ура-па. Двуокись урана может присоединять избыточное количество кислорода ( до нескольких процентов) без фазовых превращений, образуя нестехиометрическую окись. [1]
Двуокись урана как горючее для твэлов получают двумя методами. [2]
Двуокись урана является полупроводником со смешанной проводимостью. Изделия из UO2 обладают невысокой термостойкостью. Вследствие радиоактивности применение двуокиси урана и тория ограничено. [3]
Двуокись урана - порошок черного или коричневого цвета, устойчивый к действию кислот и медленно растворяющийся в азотной кислоте и царской водке. Достоинством двуокиси урана является однородность ее структуры, высокая температура плавления, недостатками - хрупкость и плохая теплопроводность. Другое соединение - монокарбид урана - обладает большой плотностью, прочностью и теплопроводностью, но менее, чем двуокись урана, устойчив к действию химических веществ, в том числе даже таких, как вода. [4]
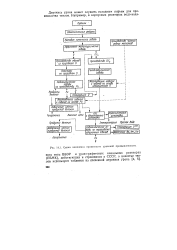 |
Схема комплекса производств урановой промышленности. [5] |
Двуокись урана может служить исходным сырьем для производства твэлов. [6]
Двуокись урана является перспективным реакторным топливом, поскольку она свободна от многих недостатков, присущих металлическому урану. Двуокись урана можно нагревать почти до точки плавления 2500 С, и, кроме того, она не реагирует с водой. Окислы урана практически не растворимы в воде. [7]
Двуокись урана растворима в минеральных кислотах. [8]
Двуокись урана является одним из важнейших соединений урана. [9]
Двуокись урана может быть получена нагреванием без доступа воздуха соединений урана ( диуранат аммония, оксалат уранила и трикарбонат уранил-аммония), при разложении которых выделяются газообразные продукты, обладающие восстановительными свойствами. [10]
Двуокись урана 1Ю2 плавится при 2700 С ( по другим источникам 2300 С), обладает радиоактивными свойствами, делающими опасной работу с ним. Большая химическая активность двуокиси урана требует особых условий оформления изделий из нее, их сушки и обжита в защитном газе или в водороде. Благодаря этим особым свойствам керамика из двуокиси урана используется лишь для специальных целей. [11]
Двуокись урана окисляется на воздухе даже при комнатной температуре. [12]
Двуокись урана U02 плавится при 2700 С ( по другим источникам 2300 С), обладает радиоактивными свойствами, делающими опасной работу с ним. Большая химическая активность двуокиси урана требует особых условий оформления изделий из нее, их сушки и обжига в защитном газе или в водороде. Благодаря этим особым свойствам керамика из двуокиси урана используется лишь для специальных целей. [13]
Двуокись урана представляет собой темно-коричневый порошкообразный минерал. Кристаллическая решетка UO2 кубическая гранецентрированная, типа флюорита. Ионы урана в решетке расположены в углах и на гранях. На рис. 79 приведена элементарная ячейка окисла. [14]
 |
Элементарная ячейка UC2. [15] |
Страницы: 1 2 3 4 5