Двуокись - азот
Cтраница 2
Двуокись азота - - бурый газ с неприятным запахом, очень ядовита, хорошо растворяется в воде. [16]
Двуокись азота играет здесь роль катализатора. [17]
Двуокись азота удобно сохранять в сконденсированном состоянии в снабженных кранами стеклянных конденсаторах, в холодильном шкафу. [18]
Двуокись азота в соответствии с ее действием на высокотемпературный процесс сильно промотирует преждевременное воспламенение топлив ( фиг. Органические перекиси, амилнитрит и нитробензол также обладают про-мотирующими свойствами. Эксперименты подтверждают предположение о том, что преждевременное воспламенение протекает по химическому механизму, сходному с высокотемпературным окислением в лабораторных условиях. [19]
Двуокись азота сама по себе является мало активным радикалом и естественно предположить, что она, реагируя с другими радикалами системы, обрывает цепи. Так как в процессах окисления ведущим радикалом является RO 2, та в результате рекомбинации должно образоваться соединение состава RC NOa. В окисленном циклогексане при инициировании кислородом полосы поглощения, приписываемые этому соединению, не были обнаружены. По-видимому, в условиях окисления ( более высокая температура) это соединение быстро распадается. [20]
Двуокись азота представляет собой бурый газ, легко сгущающийся в жидкость, кипящую при 21 С. Будучи охлаждена до - 11 С, жидкость эта застывает в бесцветную кристаллическую массу. Определение молекулярного веса по плотности пара дает цифры, лежащие между простым ( 14 2 - 16 46) и удвоенным ( 92) его значениями, причем цифры эти зависят от температуры опыта, уменьшаясь при ее повышении и увеличиваясь при понижении. [21]
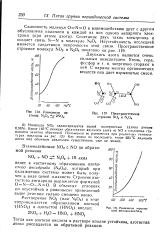 |
Пространственное строение NCX, и М О4.| Равновесие термической диссоциации NU2. [22] |
Двуокись азота является очень сильным окислителем. С парами многих органических веществ она дает взрывчатые смеси. [23]
Двуокись азота дает продукты присоединения по месту двойной связи, образуя не только нитросоединения, но и эфиры азотистой кислоты. [24]
Двуокись азота действует как острый раздражитель и в равных концентрациях оказывается более вредной, чем NO. [25]
Двуокись азота, как и другие его окислы - соединение эндотермическое. Кислород от нее отщепляется настолько легко, что горючие вещества: фосфор, уголь, парафин, в двуокиси азота горят так же легко, как и в кислороде. [26]
Двуокись азота, сообщающая азотной кислоте бурую окраску, удаляется при помощи пропускания через азотную кислоту воздуха. [27]
Двуокись азота - сильный окислитель, многие вещества горят в ней, отнимая кислород. [28]
Двуокись азота и перекись водорода не мешают определению. Могут помешать большие количества хлора и большие количества углекислого газа. [29]
Двуокись азота ( NO) - газ темнобурого цвета. При - 9 двуокись азота замерзает в бесцветные кристаллы. [30]
Страницы: 1 2 3 4