Образующаяся двуокись - марганец
Cтраница 1
Образующаяся двуокись марганца представляет собой бурый осадок, присутствие которого в растворе затрудняет определенные точки эквивалентности. Кроме того, окислительная активность перманганата калия в кислой среде гораздо выше, чем в щелочной. По этим соображениям титрование перманганатом калия чаще всего производят в кислых растворах. [1]
Образующаяся двуокись марганца носит кислотный характер. Поэтому наряду с МпО2 образуется Н2МпО3, МпЩМпОзЬ и МпМпОз и окисление ионов двухвалентного марганца замедляется. [2]
Образующаяся двуокись марганца выпадает в осадок, электролит обедняется сульфатом марганца и обогащается серной кислотой. [3]
В связи с тем, что образующаяся двуокись марганца реагирует в кислой среде с щавелевой кислотой, восстанавливаясь до Мп, результаты определения окисляемости как в кислой, так и в щелочной среде будут одинаковыми, если только анализируемая сточная вода не содержит вещестс, окисляющихся марганцовокислым калием в кислой среде и не окисляющихся в щелочной среде. [4]
Возможно, однако, что в условиях более низких значений рН скорость восстановления первоначально образующейся двуокиси марганца значительно выше, вследствие чего этот промежуточный переход не удается обнаружить. Более полно этот вопрос не исследовался. [5]
Вероятно, по причине большой скорости этой реакции кинетические исследования ее были весьма немногочисленны, и до сих пор еще не ясно, происходит ли каталитическое разложение перекиси в этих условиях под действием одной лишь образующейся двуокиси марганца или в гомогенной каталитической реакции принимают участие также и другие соединения марганца. [6]
Как указывалось выше, марганцовокислый калий является очень удобным средством для окисления боковой углеродной цепи до карбоксильной группы. В производстве его применение ограничивается необходимостью использовать образующуюся двуокись марганца. [7]
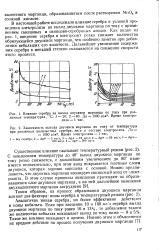
Как видно из рис. 1, введение серебра в электролит резко снижает количество образующейся двуокиси марганца, что особенно заметно при добавлении небольших его количеств. Дальнейшее увеличение содержания серебра в меньшей степени сказывается на снижении скорости этого процесса. [9]
 |
Последовательность потенциалов в ( б Е1 2 Е1 3 Е, 3. [10] |
Поэтому окисление закисного железа идет менее энергично и образование активного промежуточного окисла уменьшается. Кроме того, по-видимому, железо в виде высшей активной степени окисления быстрее реагирует с ионом Мп, чем с ионом хлора; образующаяся двуокись марганца, в отличие от хлора, не улетучивается и окисляет остающееся в растворе за-кисное железо. [11]
Основная масса изотопа J 31 используется в виде простых химических соединений: иодидов, элементарного иода, йодистых алкилов. Их приготовление из исходного высокоактивного иодида натрия проводится по методикам, принятым для обычных немеченых веществ. Так, например, при синтезе KJI31O3 без носителя раствор иодида калия окисляют перманганатом калия, а избыток последнего восстанавливают спиртом. Образующаяся двуокись марганца коагулирует при упаривании коллоидного раствора до небольшого объема и отфильтровывается. [12]
Перекись водорода в основном применяется в качестве отбеливающего вещества. От перекиси водорода требуется, чтобы она разлагала или обесцвечивала окрашенные вещества или превращала их в форму, растворимую в воде или в отбеливающем веществе. Для отбелки можно использовать как восстановитель, например двуокись серы, гидросульфит или тиосульфат, так ( и притом чаще) и окислитель, например перекисное соединение, хлор или кислородсодержащие хлоропроизводные, например гипохлориты, хлорит натрия и двуокись хлора. В небольшом количестве для отбелки применяются также бихро-маты, озон и перманганаты. В последнем случае образующуюся двуокись марганца удаляют путем последующей обработки перекисью водорода, уксусной или щавелевой кислотой. Из других перекисных соединений, которыетакже используются в качестве отбеливающих веществ, следует указать на перекись натрия, которая может заменить перекись водорода при отбелке древесной целлюлозы и для удаления краски с бумажной макулатуры или же применяться в сочетании с нею. В прачечных производственного типа, если требуется отбеливающее вещество слабого действия, или в тех случаях, когда отбелка производится случайно или в небольших масштабах, иногда применяют пероксо-борат натрия. За последние несколько лет быстро возрастает применение пероксобората в виде сухого отбеливающего вещества в домовых прачечных. [13]
Перманганат применяется для избирательного окисления 10 VVI до Vv в присутствии Сгш. Хром ( III) в кислом растворе окисляется медленно 16, в щелочном - быстро 17, образуя CrVI. Избыток перманганата можно восстановить, добавляя азид натрия, который окисляется до азота. Избыток азотистоводородной кислоты разрушают кипячением. По более старым методикам избыток перманганата удаляют кипячением с соляной кислотой или с избытком сульфата марганца ( II); образующуюся двуокись марганца отфильтровывают. [14]
Страницы: 1