Медленная диффузия
Cтраница 2
Это могло быть вызвано медленной диффузией к поверхностям следов посторонних примесей, частично нейтрализующих начальные потенциалы; но, учитывая соображения, выдвинутые Дином, Гатти и Райдилом ( см. Приложение), представляется более вероятным, что это было обусловлено переходом ионов из водной в органическую фазу, вызывающим компенсацию первоначально возникших адсорбционных потенциалов. Эти авторы указывают, что, если один или несколько ионов способны проникать через поверхность раздела и приходить в равновесие по обе ее стороны, то адсорбция не может создать постоянной разности потенциалов между фазами. Все равновесные разности потенциалов должны создаваться в результате изменений в распределении ионов между двумя жидкостями; адсорбция может создавать временную разность потенциалов, но, если ионы способны пересекать поверхность раздела, то двойной слой, обусловленный адсорбцией ( как неравной адсорбцией разноименных ионов, так и адсорбцией полярных молекул), должен в точности компенсироваться новым двойным слоем тех ионов, которые пересекли поверхность раздела. [16]
Поскольку внутридиффузионная область отвечает условиям медленной диффузии и быстрой реакции, можно было бы ожидать, что диффузия здесь является лимитирующей стадией. Однако из уравнения видно, что скорость процесса в данном случае зависит и от константы скорости реакции, и от коэффициента диффузии. [17]
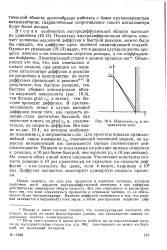 |
Изменение сд в пограничном слое. [18] |
Поскольку внутридиффузионная область отвечает условиям медленной диффузии и быстрой реакции, можно было бы ожидать, что диффузия здесь является лимитирующей стадией. Однако из уравнения (19.13) видно, что в данном случае скорость процесса зависит и от константы скорости реакции, и от коэффициента диффузии. В результате, чем быстрее реакция, тем быстрее убывает концентрация вблизи наружной поверхности ( рис. 19.3), тем больше grad CA, а значит, тем быстрее проходит диффузия. В противоположность этому в случае внешней диффузии после того, как скорость реакции стала достаточно большой, она перестает влиять на grad CA и, следовательно, на скорость диффузии. Это видно из рис. 19.4, на котором изображено изменение СА в пограничном слое. Для простоты показан прямолинейный закон изменения СА, отвечающий пленочной модели, но характер интересующей нас зависимости хорошо соответствует действительности. Но наклон обеих линий почти одинаков. Увеличение константы скорости реакции в 10 раз практически не сказалось на скорости диффузии - и не сказалось бы даже, если k возрос, например в 10е раз. Диффузия полностью лимитирует суммарную скорость процесса. [19]
 |
Линейная скорость роста полипропиленаа [ 1971. [20] |
Еще большее замедление может быть следствием медленной диффузии выталкиваемого из фронта роста атактического полимера, что увеличивает эффективную концентрацию атактического полимера на поверхности сферолита по сравнению со средней его концентрацией в расплаве. Кейт и Падден [197] обнаружили, что для атактического полипропилена достаточно высокого молекулярного веса ( выше 3000) при температурах ниже 125 - 130 С начальная линейная скорость роста сферолитов, измеренная с помощью оптической микроскопии, остается неизменной. При таких условиях диффузия была достаточно быстрой для эффективного перемешивания, и потому кончики растущего сферолита всегда прорастали через расплав с одинаковой начальной средней концентрацией атактической примеси. Хотя периметр сферолитов при таких условиях растет быстрее по сравнению с предсказанием, которое учитывает среднюю концентрацию остающегося изотактического полипропилена, вторичные и третичные внутренние разветвления должны расти значительно медленнее ( о механизме разветвления см. разд. Такое поведение изменялось, как только диффузия оказывалась достаточно интенсивной для того, чтобы произошло перемешивание. [21]
Скорость поглощения СО2 океаном ограничена из-за медленной диффузии его из поверхностных вод ( 70 - 200 м) в глубокие. Поскольку СО2 лучше растворяется в холодной воде, чем в теплой, поглощение его из атмосферы в области высоких широт больше, чем в пре - и экваториальных областях, а выделение из воды в атмосферу большее в последних. Таким образом, океан действует, как насос, перекачивающий С02 из холодных районов в теплые, где давление СО2 в атмосфере несколько выше. Примерно 1 - Ю11 т СО2 находится в непрерывном кругообороте между атмосферой и океаном, причем обмен СС2 в поверхностных слоях океана происходит в течение 5 - 25 лет, в глубоких-за 200 - 1000 лет, а полный обмен СО2 в атмосфере - за 300 - 500 лет. В виде карбоната кальция в земной коре содержится 20 - 1017 т ССу, в процессе фотосинтеза растения извлекают из воздуха около 16 - 1010 т С02 в год. [22]
Некоторое замедление процесса промывки, вызванное более медленной диффузией промывного раствора внутрь флокулы, чем к ее поверхности, несколько увеличивает высоту ступени, но не лишает возможности вести процесс. Колебательное движение не разрушает флокулы. [23]
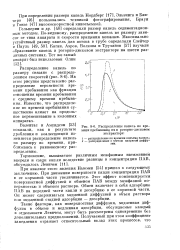 |
Распределение капель по времени пребывания их в роторно-дисковом экстракторе. [24] |
Такие факторы, как поверхностная диффузия, медленная диффузия в объеме и медленная адсорбция, обсуждаемые каждый в отдельности Левичем, могут быть рассмотрены одновременно без дополнительных предположений. [25]
Так, при быстрой электрохимической реакции и медленной диффузии устанавливается такое состояние у поверхности электрода, при котором реакция могла бы протекать с большой скоростью, но медленная диффузия этому препятствует. [26]
Уравнения (27.16) - (27.19) выражают суммарный эффект медленной диффузии и медленного карбоксилирования. Если действует только один из этих факторов, уравнения можно упростить. Чисто диффузионное лимитирование может иметь место в том случае, когда максимальная скорость диффузии гораздо меньше, чем максимальная скорость карбоксилирования. Лимитирование, вызываемое условиями карбоксилирования, должно превалировать при обратных соотношениях. [27]
Так, при быстрой электрохимической реакции и медленной диффузии устанавливается такое состояние у поверхности электрода, при котором реакция могла бы протекать с большой скоростью, но медленная диффузия этому препятствует. [28]
Первый путь - a priori определить влияние слишком медленной диффузии и малоэффективного теплообмена на развитие химического явления, происходящего в данной обстановке, и рассчитать, с какой точностью измерительные устройства могут отражать эффективное превращение реакционной системы. [29]
Большие размеры молекул полимеров, приводящие к медленной диффузии полимерных веществ в растворах, неспособности к проникновению через полупроницаемые мембраны, а также к значительному увеличению вязкости растворов с повышением концентрации, рассматривались как подтверждение указанных представлений. [30]
Страницы: 1 2 3 4