N-метилформамида
Cтраница 2
Наконец, интересно отметить, что в большинстве органических растворителей на кривой дифференциальной емкости отсутствует характерный максимум ( горб), наблюдаемый в водных растворах вблизи потенциала нулевого заряда. Исключением являются растворы в N-метилформамиде [79, 168] и в формамиде [80, 160, 161, 169], где на С, - кривых наблюдается горб, который в этих растворителях в отличие от воды сильно сдвинут в сторону отрицательных зарядов поверхности. Недостаточная ясность в вопросе о природе горба [37, 170-174] пока не позволяет, однако, однозначно связать его появление на кривых дифференциальной емкости с адсорбцией на поверхности электрода молекул воды или органического растворителя. [16]
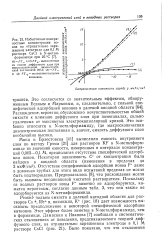 |
Избыточные поверхностные концентрации ионов на отрицательно заряженном электроде для 0 1 М раствора CsCl в N-метил-формамиде при 25 С. [17] |
Резкий додъем емкости в далекой катодной области для растворов Cs, Rb и, возможно, К ( рис. 18) дает возможность высказать предположение о некоторой специфической адсорбции катионов. Этот эффект более заметен в N-метилформамиде, чем в формамиде. [18]
Потенциалы отсчитывались относительно потенциала полуволны Т1 в N-метилформамиде. [19]
Общим для полученных С, - кривых в органических растворителях является снижение емкости двойного слоя по сравнению с водными растворами, по-видимому, как в результате уменьшения диэлектрической проницаемости в двойном слое, так и под влиянием увеличения расстояния между его обкладками. Тот факт, что снижение емкости наблюдается также в случае растворов в N-метилформамиде [79, 168], у которого макроскопическая диэлектрическая проницаемость значительно больше, чем у воды, не позволяет согласиться с выводом работы [160], в которой предполагается существование прямой пропорциональности между макроскопической диэлектрической проницаемостью растворителя и эффективной диэлектрической проницаемостью в двойном слое при насыщении. [20]
Специфическая адсорбция ионов Cs, по-видимому, происходит сильнее из диметилформамида, чем из формамида и N-метилформамида. CsCl ( при - 1 6 В относительно водного НКЭ), сообщенного Дамаскиным и Ивановой [7] для N-метилформамида. Это подтверждается измерениями емкости [46] для растворов Csl ( рис. 22), где обнаруживаются резкое возрастание емкости и сильная концентрационная зависимость в катодной области. Кривые для LiCl ( рис. 23), напротив, совершенно плоские и почти не зависят от концентрации. [21]
Хотя диметилформамид - один из наиболее широко используемых в электрохимии неводных растворителей при исследованиях строения двойного слоя, его изучали меньше, чем формамид и N-метилформамид. Это отчасти обусловлено довольно невыразительным видом кривой емкость - потенциал в диметилформамиде, которая в отличие от формамида и N-метилформамида не имеет характерного широкого горба емкости в катодной области. О первых измерениях в диметилформамиде сообщили Минц, Ястрзебска и Брзостовска [46] в 1961 г. Кривые емкости, приведенные для растворов Csl и LiCl ( рис. 22 и 23), похожи на соответствующие кривые для метанольных растворов. [22]
N-метилформамида уменьшается, что указывает на частичную десорбцию органических молекул с поверхности ртути. Этот результат может быть объяснен уменьшением эффективной диэлектрической проницаемости в двойном электрическом слое при вхождении в него молекул формамида или N-метилформамида. Таким образом, как это впервые было отмечено Фрумкиным [68], не существует простой зависимости между эффективной диэлектрической проницаемостью в двойном слое и макроскопической диэлектрической проницаемостью растворителя. [23]
Метилформамид обладает самой высокой диэлектрической постоянной ( 182 4) из всех рассматриваемых растворителей. Несмотря на подобные свойства, N-метилформамид очень редко использовался в качестве растворителя электролитов. Единственной информацией о N-метилформамиде является краткое сообщение Хале и Парсонса [1] о его применении при полярографическом восстановлении Tl, Cd2 и РЬ2 на КРЭ. [24]
Метилформамид обладает самой высокой диэлектрической постоянной ( 182 4) из всех рассматриваемых растворителей. Несмотря на подобные свойства; N-метилформамид очень редко использовался в качестве растворителя электролитов. Единственной информацией о N-метилформамиде является краткое сообщение Хале и Парсонса [1] о его применении при полярографическом восстановлении Т1, Cd2 и РЬ2 на КРЭ. [25]
Специфическая адсорбция катиона ( C g N из N-метилформамида, как сообщали Дамаскин и Поваров [9], значительно слабее, чем из водного раствора. Это было отнесено за счет более сильной адсорбции растворителя в растворах N-метилформамида. Однако более важным фактором, вероятно, является более сильная сольватация иона в N-метилформамиде. Максимальное понижение емкости происходит в области горба, так как, согласно теории переориентации диполей, объясняющей появление горба, растворитель может менее прочно удерживаться в этой области. [26]
Это обратно той последовательности, которую можно ожидать на основе значений энергий, требуемых для замещения растворителя. Однако различия велики и, вероятно, вызваны различиями в энергии сольватации, а не в адсорбции растворителей. Дамаскин, Иванова и Сурвила [8] предположили, что увеличение энергии сольватации солей при переходе от воды к формамиду и N-метилформамиду обусловлено главным образом возросшей сольватацией аниона, приводящей к более низкой поверхностной активности анионов, что и установлено экспериментально. [27]
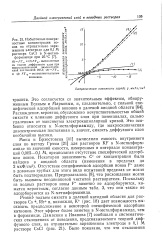 |
Избыточные поверхностные концентрации ионов на отрицательно заряженном электроде для 0 1 М раствора CsCl в N-метил-формамиде при 25 С. [28] |
Минц и Брзостовска [41] вычислили емкость внутреннего слоя по методу Грэма [21] для растворов KF в N-метилформ-амиде из значений емкости, измеренных в интервале концентраций 0 005 - 0 1 М, предполагая отсутствие специфической адсорбции ионов. Отсутствие специфической адсорбции ионов F - даже в довольно грубых для этого вида испытаний пределах не могло быть подтверждено. Предполагалось [8], что расхождения могли быть вызваны неодинаковой чистотой растворителя. Поскольку из водных растворов ионы F - заметно не адсорбируются, кажется вероятным, согласно данным табл. 3, что они также не адсорбируются из N-метилформамида. [29]
Поскольку свободная энергия твердой соли AgX постоянна, изменения / ( S2 по мере изменения растворителя отражают разницу в свободных энергиях ионов Х - и AgXF. Если AgXT сильнее сольватируется, чем X, то К 2 будет больше единицы; если справедливо обратное, то / ( S2 будет меньше единицы. Простейшая модель диэлектрического континуума, не содержащего специфических связей между ионами и растворителем, на основании размера предсказывает, что K. Сильная водородная связь аниона с растворителем ( как в воде, спиртах, формамиде и N-метилформамиде) вызывает сдвиг равновесия влево, уменьшая % &. С другой стороны, координация растворителя к ионам серебра в комплексе сольватирует AgXiT сильнее и сдвигает равновесие вправо, в результате чего KS2 становится больше единицы. [30]
Страницы: 1 2