N-число
Cтраница 3
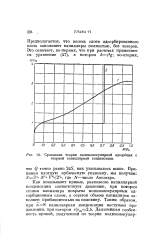 |
Сравнение теории полимолекулярной адсорбции с теорией капиллярной конденсации. [31] |
Принимая плотную кубическую упаковку, мы получим: S i Nll F3 / / 23 /, где N-число Авогадро. [32]
В каждой полосе, полученной в результате расщепления одного атомного уровня, размещается 2N квантовых состояний электрона, где N-число атомов. [33]
Вековое уравнение ( 2 38), из которого находятся частоты нормальных колебаний, имеет порядок 3N, где N-число атомов, образующих молекулу. Поэтому даже в случае небольшого числа атомов N решение векового уравнения представляет нелегкую задачу. Если, однако, молекула обладает симметрией, то известными свойствами симметрии обладают также ft нормальные колебания и колебательные собственные функции, а это приводит к существенному упрощению решении задачи об определении нормальных колебаний. [34]
Очевидно, что SN s - N, где % - ход резьбы в мм, s - шаг резьбы в мм, N-число ходов. [35]
Очевидно, что SN s - ff, где % - ход резьбы в мм, s - шаг резьбы в мм, N-число ходов. [36]
Для подсчета числа изомеров нельзя составить какой-либо общей формулы ( подобно, например, формуле для га-го члена бинома Ньютона), выражающей N-число возможных изомеров через данное п-число атомов углерода. Подсчет возможен лишь с помощью так называемых рекуррентных формул, позволяющих найти число изомеров углеводорода с ( п - 1) атомами углерода, если известно число изомеров предыдущего гомолога, содержащего п атомов углерода. [37]
Для подсчета числа изомеров нельзя составить какой-либо общей формулы ( подобно, например, формуле для й-го члена бинома Ньютона), выражающей N-число возможных изомеров через данное п-число атомов углерода. Подсчет возможен лишь с помощью так называемых рекуррентных формул, позволяющих найти число изомеров углеводорода с ( п - - 1) атомами углерода, если известно число изомеров предыдущего гомолога, содержащего п атомов углерода. [38]
Для подсчета числа изомеров нельзя составить какой-либо общей формулы ( подобно, например, формуле для п-го члена бинома Ньютона), выражающей N-число возможных изомеров через данное п - число атомов углерода. Подсчет здесь возможен лишь с помощью так называемых рекуррентных формул, позволяющих подсчитать число изомеров углеводорода с ( п - - 1) атомами углерода, если известно число изомеров предыдущего гомолога, содержащего п атомов углерода. [39]
Барометрическая формула может быть написана в более удобном виде, если заменить массу М моля газа на Nm, где m - масса молекул, а N-число Авогадро. [40]
 |
Изменение влияния различных факторов на. [41] |
В этих уравнениях Z-высота колонны, необходимая для данного разделения, V-скорость пара, р-плотность, т ] - вязкость, г-радиус колонны, Dv-коэффициент диффузии, N-число молекул в 1 мл, d - средний эффективный диаметр молекулы и v-средняя квадратичная скорость молекул. Предполагается, что разгонка происходит в пустой трубке; для получения численного значения некоторых из приведенных выше величин были сделаны упрощающие предположения. Со времени опубликования работы Докси и Мэя не было сделано никаких дальнейших исследований в подтверждение этого подхода к решению проблем ректификации. [42]
Обозначения: р-давление; V-объем; Т - термодинамическая температура; m - масса вещества; р-плотность вещества; М - молярная масса; v-число молей; N-число молекул в газе; п-плотность молекул; / п - масса молекулы; Ч - средняя арифметическая скорость молекулы; VKB-средняя квадратичная скорость молекулы; W-средняя энергия молекулы; WnocT-средняя энергия поступательного движения молекулы; i-число степеней свободы молекулы; Х - средняя длина свободного пробега молекул; D-коэффициент диффузии; т ] - динамическая вязкость; U - внутренняя энергия термодинамической системы; Q-количество теплоты ( Q О, если система поглощает теплоту, Q 0, если отдает); А - работа ( А О, если система совершает работу, А 0, если над системой совершается работа): С-теплоемкость системы, с-удельная теплоемкость системы; су, ср-удельные теплоемкости при постоянном объеме и постоянном давлении; Ст у, Ст р-соответствующие молярные теплоемкости; Y - коэффициент Пуассона; S - энтропия состояния; k - постоянная Больцмана; N & - постоянная Авогадро; К - молярная газовая постоянная. [43]
Все величины помечаются большими буквами ( рис. 12.11), например: И-толщина, / - натяжение, V-скорость полосы, Мн - момент нагрузки на привод валков; N-число оборотов валка в минуту. [44]
Если газ находится в равновесном состоянии, то все молекулы будут характеризоваться одной и той же средней энергией и E / N, где Е - полная энергия газа, N-число частиц. [45]
Страницы: 1 2 3 4 5