Дихромат-ион
Cтраница 3
При дихроматометрическом титровании индикатором служит дифениламин, окрашивающий раствор в синий цвет при избытке дихромат-ионов. Иодометрическое титрование используется для анализа растворов окислителей, в этом случае титрованный раствор содержит иодид-ион. [31]
VI) концентрации хромат - и дихромат-ионов одинаковы; при каком рН 99 % хрома содержится в виде дихромат-ионов. [32]
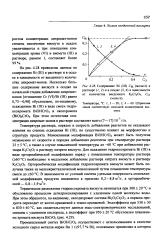 |
Содержание Bi ( III CBJ ( моль / л в. [33] |
На рис. 4.28 приведены данные по содержанию Bi ( III) в растворе и в осадке в зависимости от введенного количества дихромат-ионов. [34]
Хлорид-ионы окисляются в кислой среде с образованием хлора только сильными окислителями - двуокисью марганца или свинца, перманганат-ионами МпО -, дихромат-ионами Сг2О -, хлорат-ионами С1О, гипохлорит-ионами СЮ - и некоторыми другими. [35]
Но чаще всего Н2О2 выступает в роли окислителя, восстановительные же свойства проявляются в реакциях с наиболее сильными окислителями, такими как перман-ганат - или дихромат-ион в кислой среде. [36]
Сущность работы: одновременное определение концентрации двух веществ ( хрома и марганца) при их совместном присутствии основано на различии спектров поглощения окрашенных растворов перманганат - и дихромат-ионов. [37]
Хлориды не восстанавливают серную кислоту, проявляя восстановительную активность лишь по отношению к более сильным окислителям - концентрированной азотной кислоте, хлорат -, перманганат - и дихромат-ионам в кислой - среде. Реакция между хлоридами и концентрированной серной кислотой ограничивается лишь обменным взаимодействием. [38]
Хлориды не восстанавливают серную кислоту, проявляя восстановительную активность лишь по отношению к более сильным окислителям - концентрированной азотной кислоте, хлорат -, перманганат - и дихромат-ионам в кислой среде. Реакция между хлоридами и концентрированной серной кислотой ограничивается лишь обменным взаимодействием. [39]
Так, для окисления нитрит-иона в нитрат ( р - 0 01 В) или бромид-иона в бром ( р - 1 09 В) следует использовать только дихромат-ион, так как окислительной силы хроматного аниона для таких партнеров оказывается недостаточно. [40]
Обнаружение хромат - и дихромат ионов. Для обнаружения хромат - и дихромат-ионов используются реакции образования желтых осадков ВаСгО4 ( см. с. [41]
Обнаружение хромат - и дихромат ионов. Для обнаружения хромат - и дихромат-ионов используются реакции образования желтых осадков ВаСЮ4 ( см. гл. [42]
Рассмотрим более сложный пример. Возможно ли взаимодействие фторид-иона с дихромат-ионом в кислой среде. Для написания реакций нужно хорошо знать свойства элементов и их соединений. Дихромат калия в кислой среде, будучи окислителем, переходит в ион трехвалентного хрома. [43]
По первой стадии образуется ион Сг2О92 - ( изобразите его строение структурной формулой), придающей раствору сине-фиолетовую окраску. Этот ион неустойчив и распадается на исходный дихромат-ион и кислород. Таким образом, дихромат калия отвечает двум главнейшим требованиям, входящим в определение катализатора: он ускоряет процесс распада пероксида водорода и в то же время после окончания процесса возвращается в реакционную систему в том же исходном состоянии и в той же концентрации. [44]
Метод основан на окислении хрома до дихромат-иона персульфатом аммония, затем дихромат-ион образует в результате окисления дифенилкарбазида красно-фиолетовое окрашивание. Определяют 5 - 30 мкг в 100 мл раствора. Железо комплексуют фосфорной кислотой, мешают молибден и 10-кратное избыточное количество ванадия. [45]
Страницы: 1 2 3 4