Джиока
Cтраница 1
 |
Прокладки между слоями трубок в витых теплообменниках. [1] |
Джиока ( рис. 103, б) имеют выступы для обеспечения осевого зазора. [2]
Воспользуйтесь данными Джиока и Рурвейна, цитированными в этой главе, и данными Фреденхагена и Маске, приведенными в гл. [3]
Американский химик Уи льям Джиок ( Гиок, 1895 - 1982) открывает метод достижения температур, отличающихся от абсолютного нуля на тысячную долю градуса. [4]
После написания этой главы стала известна работа Шерли и Джиока [3709] по измерению теплоемкости кристаллического йода от 13 до 327 К, согласно которой Я 2в8 15 - HO 3154 кал. [5]
Влияние магнитного поля может быть описано при помощи формулы Фрица и Джиока, приведенной выше. [6]
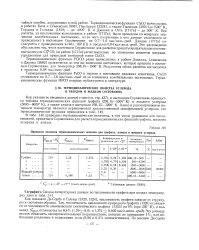 |
Принятые значения термодинамических величин для графита, алмаза и жидкого углерода. [7] |
Термодинамические функции СЬСО вычислялись в работах Бича и Стивенсона [698], Пертьерра [3224], а также Томпсона [3970] до 1500 К, Гордона и Голанда [ 18181 - до 4000 К и Джиока и Отта [ 1717а ] - до 500 К. Все расчеты, за исключением выполненных в работе [ 1717а ], были проведены по неверным значениям колебательных постоянных, из-за чего полученные в них данные отличаются от приведенных в настоящем Справочнике на 0 7 - Л 6 кал / моль-град. Данные [ 1717а ] согласуются с приведенными в табл. 162 ( II) в пределах 0 04 кал / моль - град. Это расхождение обусловлено тем, что в настоящем Справочнике для расчетов приняты вращательные постоян-ные молекулы ClfCO, авработе [ 1717а ] расчет выполнен по значениям моментов инерции, усредненным для природной изотопной смеси СЬСО. [8]
В табл. 16 приведены также значения энтропии, вычисленные но данным о теплоемкости. Джиока и Мак-Дугалла имеются некоторые систематические расхождения. [9]
Опубликованные в Термохимических таблицах [1435] значения термодинамических функций были рассчитаны на основании выполненных Лайде и Манном [869] отнесений колебаний и расчетных величин длин связей и углов между атомами. Низкотемпературные данные Кехлера и Джиока [785] свидетельствуют о беспорядочной ориентации молекул перхлорилфторида в твердом состоянии. [10]
Опубликованные в Термохимических таблицах [1435] значения термодинамических функций были рассчитаны на основании выполненных Лайде и Манном [869] отнесений колебаний и расчетных величин длин связей и углов между атомами. Низкотемпературные данные Кехлера и Джиока [785] свидетельствуют о беспорядочной ориентации молекул перхлорилфторида в твердом состоянии. [11]
Фиккетт и Кауан [1555, 1556] экстраполировали термодинамические функции СО, рекомендуемые в работе [3680], до температуры 12 000 К, так же как это было сделано ими для ряда других газов ( см., например, стр. При температурах до 10 000 К расхождения между данными Фиккетта и Кауана и величинами, приведенными в настоящем Справочнике, так же как в случае других таблиц, основанных на расчетах Клейтона, Джиока, Джонстона и Дейвиса, имеют величину примерно 0 086 кал / моль - град. [12]
В 1961 г. Зьомек и Петровский [43896] опубликовали таблицу значений термодинамических функций РОС13, вычисленную по тем же значениям молекулярных постоянных, что и в настоящем Справочнике для Т 200 - 1000 К. Соответствующие значения термодинамических функций РОС13, приведенные в работе [43896] и в табл. 126 ( II), совпадают. Возражения Отта и Джиока [ 3152а ] в работе [43896] не были рассмотрены. [13]
Это казалось маловероятным до тех пор, пока характеристические температуры процессов, которые могли быть использованы для охлаждения, имели тот же порядок величины, что и колебательные кванты. Положение изменилось, когда в парамагнитных солях были открыты сильно неупорядоченные состояния с гораздо меньшими значениями характеристической температуры. По предложению Дебая и Джиока, эти соли были использованы для получения весьма низких температур. В настоящее время получены и измерены по термодинамической шкале температуры порядка 0 001 К. [14]
При обычных температурах, когда ( д ] / дТ) н в соответствии с ( 3 - 78) сравнительно мало ( так как велико Т2), а теплоемкость ся р, наоборот, значительна, величина ( дТ / дН) 5 р оказывается весьма малой. Что же касается низких температур. Однако в 1923 г. было обнаружено, что для некоторых парамагнитных солей зависимость типа ( 3 - 13) сохраняется до температур жидкого гелия. Именно это обстоятельство и позволило Дебаю и Джиоку предложить использовать адиабатное размагничивание некоторых парамагнитных солей для получения температур ниже 1 К. [15]
Страницы: 1 2