Длина - связь
Cтраница 1
Длины связей в SiCl4 и в других галогенидах более тяжелых элементов обычно меньше сумм радиусов при одинарной связи; для SiCU такое различие составляет 16 пм. Весьма вероятно, что это различие можно истолковать как свидетельство того, что связи имеют в известной мере характер двойной связи, обусловленной резонансом такого же типа, как только что рассмотренный. [1]
Длины связей в молекулах можно принимать неизменными для любых конформаций, если задача заключается в предсказании оптимальной геометрии с точностью, близкой к экспериментальной. Как показывают расчеты конформаций малых молекул [29, 30], вариации длин связей обычно не превышают 0 01 А. По-видимому, в карбоцеп-вых полимерах длины связей С-С могут меняться в пределах 1 54 - 1 56 А. Такие небольшие изменения практически не сказываются на координатах атомов и параметрах спирали. [2]
Длины связей могут меняться в очень небольших пределах-от 0 01 до 0 02 А. [3]
Длины связей тоже согласуются с эффективным числом связывающих электронов в молекуле. [4]
Длины связей В - В равны 177 пм, а В - Н равны 133 пм ( для мостиковых атомов водорода) и 119 пм ( для внешних атомов водорода), а это свидетельствует о долевом характере связей, когда каждая связь требует менее одной электронной пары. В рассматриваемой молекуле имеется шесть пар валентных электронов и девять связей; следовательно, в среднем каждая связь соответствует 2 / з одинарной связи. Длины связей указывают на то, что шесть электронных пар резонируют между девятью положениями так, что пять центральных связей требуют около пяти валентных электронов, а четыре внешние связи требуют около семи валентных электронов. [5]
Длины связей и углы между ними определены Флайгаром и Хо-ве [434] методом микроволновой спектроскопии, а также Хоффманом [610] методом дифракции электронов; полученные в обоих работах данные хорошо согласуются между собой. Эти данные использованы для расчета термодинамических функций. Броерс, Кетелаар и Ван Фелден [172] экспериментально установили Ттп 193 1 К и АНт 1 72 ккал / молъ. Кетелаар, Ван Фелден и Цалм [743] измеряли давление пара в температурном интервале от 240 до 372 К и установили, что ТЪ 333 8 К. [6]
Длина связи С-С в бензоле, промежуточная между длинами ординарной и двойной связей ( см. табл. 9), формула Кекуле с чередующимися и разными по длине связями С-С и СС не отвечает опыту. Гипотетический бензол Кекуле должен был бы так же активно присоединять молекулы галогенов по месту двойных связей, как непредельные углеводороды, что не наблюдается. Для бензола, напротив, характерны реакции замещения водорода на галоген. [7]
Длины связей и валентные углы в функциональных и углеводородных группах варьируют от соединения к соединению лишь незначительно. В табл. 6.1. приведены обычные длины связей в органических соединениях, а в табл. 6.2 - валентные углы ( углы между связями) в функциональных и углеводородных группах. Отклонения от приведенных значений длин связей редки, так как энергии растягивания и сжатия связей высоки. Напротив, небольшие ( менее 10) изменения нормальных валентных углов требуют лишь малых затрат энергии и имеется множество случаев, когда эти углы несколько сжаты или расширены. Значительная деформация валентного угла в молекуле ведет к аномально высокой химической активности, но число подобных систем невелико. Если геометрия молекулы требует изменения обычных валентных углов, то деформация распределяется между всеми возможными углами. [8]
Длина связи С-С ( 1 542Л) в алмазе обычно принимается даже - за стандарт ординарной С ( s / з3) - С ( sp3) 0-связи. [9]
Длины связей часто рассматриваются как подтверждение или свидетельство против резонансной стабилизации в молекуле. Однако в этом вопросе должна соблюдаться некоторая осторожность. Например, если гибридная структура бензола рассматривается как суперпозиция двух структур Кекуле, то каждая связь углерод - углерод должна быть чем-то средним между простой и двойной связями. Таким образом, можно ожидать, что длины углерод-углеродных связей в бензоле будут средним арифметическим между длинами простой и двойной связей. Однако средняя величина между С - С-связью в этане ( 1 543 А) и в этилене ( 1 337 А) составляет 1 441 А, что заметно отличается от экспериментально определенной длины связи С - С в бензоле, равной 1 397 А. Причина расхождения кроется главным образом в сделанном при этом ориентировочном расчете допущении, согласно которому в отсутствие резонанса все простые связи С - С должны быть равны 1 54 А. Совершенно очевидно, что это допущение необосновано, поскольку, как уже говорилось, энергии связей зависят от окружения, а вследствие того, что существует зависимость между энергиями связей и их длинами ( см. рис. 9 - 1) последние также должны изменяться в зависимости от окружения. [10]
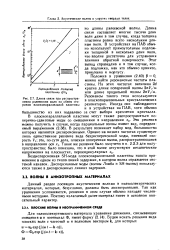 |
Длина связи при распространении рэлеевских волн по обеим сторонам плоскопараллельной пластины. [11] |
Длина связи составляет многие тысячи длин волн даже в том случае, когда толщина пластины равна всего нескольким длинам волн. В устройствах на ПАВ обычно используют прямоугольные подложки толщиной в несколько длин волн, что вполне достаточно для устранения влияния обратной поверхности. Этот вывод справедлив и в том случае, когда подложка, как это обычно принято, приклеена к корпусу. [12]
Длина связи a SOf равна 144 пм, И, таким образом, рассчитанный здесь радиус ( радиус сферы, представляющей молекулу) оказывается вполне вероятным и совместимым с низкой степенью сольватации. [13]
Длина связи равна атомному диаметру или кратчайшему расстоянию между атомами. [14]
Длина связи в ионе СО § является промежуточной между длиной одинарной и двойной связей. [15]
Страницы: 1 2 3 4