Добавление - неэлектролит
Cтраница 1
Добавление неэлектролитов для увеличения у г - Чувствительность анализа можно также повысить, увеличив коэффициенты активности растворенных компонентов. С этой целью к анализируемой пробе добавляют неэлектролиты. Так, например, чувствительность определения органических соединений, растворенных в органических растворителях, смешивающихся с водой, можно значительно увеличить, добавляя к пробе воду. [1]
Из табл. 4.9 следует, что изменение подвижности ионов при добавлении неэлектролитов зависит не только от изменения вязкости раствора, но также от других факторов. В растворах различных неэлектролитов с равной вязкостью подвижность данного иона неодинакова. Изменение вязкости, вызванное глицерином, снижает ионную подвижность заметнее, чем в случае изменения вязкости маннитом или сахарозой. [2]
Такое поведение должно быть результатом резких изменений структуры растворителя по мере добавления неэлектролита к воде и, как следствие, уменьшения роли гидрофобных эффектов и возрастания 0 роли обычного сольватационного механизма растворения, в котором № растет энергия образования поло-а - - - - оде стей и более непосредственно проявляются донорно-акцепторные свойства молекул [ ср. Для сравнения на рис. VI.2 приведены АЯ5 неэлектролитов в неводных бинарных растворителях. Несмотря на большую разницу в свойствах растворителей и растворяемых молекул, характер зависимости ДЯ5 ( х2) очень прост во всех случаях, что является резким контрастом водным растворам. [3]
В целом, приведенные данные еще раз демонстрируют определяющую роль гидрофобной гидратации в формировании отрицательного начального хода объемного эффекта смешения при добавлении неэлектролитов к воде. Причина bv О для раствора ацетонитрила обсуждается ниже, в связи с рассмотрением концентрационной зависимости Фу2 ( я) Для некоторых систем. [4]
В литературе имеются данные о влиянии этилового спирта, глицерина, этиленгликоля и сахарозы па активность электролитов, причем авторы указывают, что добавление вышеназванных неэлектролитов не является безразличным. [5]
Различие в механизмах прототропной проводимости ионов водорода и гидроксила обнаруживается также в том, что проводимость и числа переноса кислот и оснований при добавлении неэлектролитов изменяются по-разному. Произведение Ац для водных растворов КОН с увеличением содержания метанола, этанола и пропааола вначале возрастает, достигает максимума при концентрации спирта 6 - 8 мол. Влияние гликоля и глицерина заметно иное. Произведение Лг) для растворов КОН плавно снижается до содержания гликоля 15 мол. В присутствии глицерина минимум Аг соответствует его содержанию примерно 8 мол. Прл большем содержании глицерина Лг) ощутимо возрастает. При, добавлении небольшого количества гликоля или глицерина проводимость ионов гидроксила снижается в большей мере, чем вследствие повышения вязкости раствора. В отличие от других изученных ионов разупорядочивающее действие ионов гидроксила перекрывается другим эффектом. Заслуживает особого внимания быстрое возрастание значения Аг при повышении концентрации глицерина. [6]
Коагуляция может наступить при действии на коллоидную систему таких различных по своей природе факторов, как длительный диализ ( очистка золей), добавление растворов электролитов, добавление неэлектролитов, механическое воздействие ( размешивание или встряхивание), сильное охлаждение или нагревание, пропускание электрического тока и, наконец, действие лучистой энергии. [7]
Он считает, что теория препятствий неудовлетворительно описывает изменения проводимости при добавлении неэлектролита в раствор и, кроме других факторов, следует учитывать изменение ассоциации электролита в присутствии растворенного неэлектролита. [8]
При этом концентрации летучих примесей в равновесной паровой фазе повышаются в 2 - 8 раз в зависимости от применяемой соли. Наилучшие результаты дает карбонат калия. При добавлении неэлектролитов, например воды, повышается чувствительность определения органических соединений, растворенных в органических растворителях, смешивающихся с водой. [9]
Медленная коагуляция идет часами и сутками. При медленной коагуляции агрегация идет вначале между сильно разряженными частицами, а затем соединяются частицы с большей величиной - потенциала. Возможность коагуляции возрастает при всех условиях, снижающих величину - потенциала, а именно: при адсорбции ионов, добавлении неэлектролитов, образующих сольваты и гидраты со средой, при поверхностных химических реакциях. [10]
С возрастанием концентрации неэлектролита эквивалентная проводимость резко снижается, а в спиртовых растворах после прохождения минимума при небольшом содержании воды повышается. Минимум проводимости соответствует содержанию спирта 90 мол. Эквивалентная проводимость растворов КОН также быстро падает при добавлении неэлектролитов ( рис. 4.30 и 4.31), но минимум проводимости обнаруживается лишь в растворах с метанолом. Плавный минимум проводимости КОН соответствует содержанию метанола около 75 мол. [11]
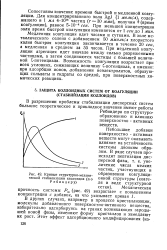 |
Кривые структурно-механической стабилизации коллоидов ( п о Р ебиндеру. [12] |
Медленная коагуляция идет часами и сутками. В золе металлического селена с добавлением 50 ммоль / л хлористого калия быстрая коагуляция заканчивается в течение 20 сек, а медленная в среднем за 55 часов. При медленной коагуляции агрегация идет вначале между сильно разряженными частицами, а затем соединяются частицы с большей величиной С-потенциала. Возможность коагуляции возрастает при всех условиях, снижающих величину С-потенциала, а именно: при адсорбции ионов, добавлении неэлектролитов, образующих сольваты и гидраты со средой, при поверхностных химических реакциях. [13]
Тот факт, что оба эти растворителя имеют большие дипольные моменты, предполагает, что это может быть следствием изменения полярности на рис. 3.20. Вода вызывает обычное снижение Лг ] в расплавах N2H C1 -, но эта система может включать ионные пары, связанные водородной связью. Остается посмотреть, является ли это только взаимодействием достаточно малого аниона и достаточно большого дипольного момента или более специфическим взаимодействием. Поскольку в обоих типах систем собственно электропроводность проходит через максимум, в то время как ц монотонно растет, поведение Лт ] является результатом наложения обеих закономерностей. Анализ электропроводности в области IV для нескольких систем привел Линда и Сагемана [347] к выводу о снижении подвижности ионов при добавлении больших молекул неэлектролита и об увеличении подвижности ионов при добавлении неэлектролитов с небольшими молярными объемами. В последнем случае неэлектролит выступает в роли агента, занимающего пространство, освобождаемое мигрирующим ионом, причем не требующим согласованного движения других ионов, что необходимо, когда размер молекулы неэлектролита превышает размер большего иона. [14]
Страницы: 1