Дальнейшее добавление - электролит
Cтраница 1
Дальнейшее добавление электролита гидро-фобизирует остальную поверхность глинистых частиц, давая им возможность слипаться пп большей части поверхности, в этом случае наблюдается гидрофобная коагуляция системы. Концентрированные системы при этом затвердевают, выпрессовывая воду ( синерезис), а разбавленные - разжижаются и становятся подвижными. В последнем случае система может расслаиваться - твердая фаза выпадает в осадок, и высвобождается значительное количество воды. [1]
При дальнейшем добавлении электролита заряд и гидратация частиц начинают уменьшаться, в результате чего возрастают возможности слипания частиц друг с другом. Вначале слипание происходит преимущественно по граням и углам частиц. При этом усиливаются тиксотропные свойства бурового раствора, повышаются вязкость и предельное статическое напряжение сдвига. Этот интервал изменения концентрации электролита называется областью структурообразования. [2]
При дальнейшем добавлении электролита увеличивается его концентрация в растворе. [3]
В результате дальнейшего добавления электролитов к глинистому раствору потеря защитных свойств охватывает все большую поверхность глинистых частиц, которые слипаются уже не только своими концами, но и всей поверхностью. Глинистый раствор при этом настолько загустевает, что становится почти твердым. В связи с гидрофобизацией большей части поверхности глинистых частиц такая коагуляция называется гидрофобной. [4]
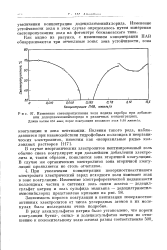 |
Изменение светопропускания золя иодида серебра при добавлении додециламмонийхлорида в различных концентрациях. Длина волны 650 ммк. порог коагуляции исходного золя 0 08 ммолъ / л. [5] |
В случае неорганических электролитов пептизированный золь обычно снова коагулирует при дальнейшем добавлении электролита и, таким образом, появляется зона вторичной коагуляции. В случае же органических электролитов зона вторичной коагуляции проявляется не столь отчетливо. [6]
Измерение вязкости частично нейтрализованных водных растворов ПЭИ [64] показывает, что максимум вязкости лежит при 80 % - ной нейтрализации. Дальнейшее добавление электролита лишь экранирует заряды нитеобразной молекулы полимера. Этим снижается электростатическое отталкивание ионизированных групп, в результате чего вытянутые нити ионизированного ПЭИ все больше переходят в статистические клубки, как в незаряженных нитевидных молекулах. ПЭИ ( с солянокислой и 1-диметиламинонафталин - 5 - сульфокИ Слотой) соответствует по своему размеру всей молекуле. Другими словами, полимерная цепь в молекуле ионизированного ПЭИ является настолько жесткой, что она вращается как единое целое. [7]
Вначале содержание введенного электролита многозарядных ионов недостаточно, чтобы скоагулировать золь; при этом дзета-потенциал частиц выше критического его значения. Дальнейшее добавление электролита приводит к тому, что его ионы начинают проявлять коагулирующее действие. Указанный интервал концентраций отвечает значениям электролитического потенциала частиц от критического дзета-потенциала gKp одного знака до gKp противоположного знака. [8]
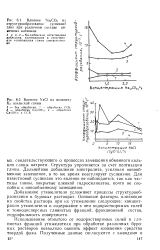 |
Влияние Na2CO3 на структурообразование суспензии глин при различном составе обменных катионов.| Влияние N aCl на величину Кс асканской глины. [9] |
Структура упрочняется за счет пептизации глины. Дальнейшее добавление электролита, усиливая ионообменное замещение, в то же время коагулирует суспензию. Для известковой суспензии это явление не наблюдается, так как частицы глины, покрытые пленкой гидросиликатов, почти не способны к ионообменному замещению. [10]
Определена зависимость удельной электропроводности амфолита АСМПТ-10 при равновесии с раствором КС1 от концентрации последнего. При низких концентрациях КС1 электропроводность амфолита АСМПТ-10 выше электропроводности равновесного раствора, причиной чего является более высокая концентрация ионов в ионите. При дальнейшем добавлении электролита электропроводность раствора растет быстрее электропроводности амфолита. [11]
В 1900 г. Гарди впервые предположил, что устойчивость коллоидов связана с электростатическим отталкиванием между их частицами; таким образом, возникла мысль о том, чтобы искать связь между - потенциалом и коллоидной устойчивостью. Подобные исследования ( проведенные, например, Повисом в 1914 г.) показали, что скорость коагуляции действительно растет, когда - потенциал уменьшается вследствие повышения концентрации электролита. При определенном, достаточно низком значении - потенциала, называемом критическим потенциалом, начинается быстрая коагуляция. Дальнейшее добавление электролита уже не влияет на скорость коагуляции. Интересно, что в большинстве случаев значения критического потенциала не зависят от типа использованного электролита. [12]
С точки зрения экономичности процесса распылительной сушки необходимо стремиться использовать суспензии с минимальной влажностью. В то же время снижение влажности, при прочих равных условиях, приводит к увеличению вязкости и, как следствие, к ухудшению условий транспортирования и распыления. Механизм этого явления весьма сложен, и в настоящее время еще нет теории, которая позволяла бы не только с количественной, но в ряде случаев даже с качественной стороны оценить вероятный эффект воздействия той или иной добавки. Подбор вида электролита и его количества ведется эмпирическим путем - построением так называемых кривых разжижения, характеризующих изменение вязкости или текучести суспензии от содержания электролита. Из рисунка видно, что вязкость вначале резко снижается, затем почти не изменяется и, наконец, при дальнейшем добавлении электролита начинает увеличиваться. Снижение вязкости Куколев объясняет увеличением диффузного слоя ионов ( возрастает - потенциал) и, следовательно, снижением сопротивления водных пленок сдвигу. Увеличение вязкости объясняется сжатием слоя и ассоциацией частиц каолина. С целью повышения разжижающего эффекта в глину рекомендуется вводить соду ( Na2COs), анионы которой образуют с катионами магния и кальция труднорастворимые и выпадающие в осадок соли. [13]
Страницы: 1