Циклопентадиеновое кольцо
Cтраница 1
Циклопентадиеновое кольцо в получающемся комплексе меди рассматривается обычно, как связанное с металлом о-связью. Поскольку используемые окислы металлов имеют основной характер, то данные реакции можно рассматривать как нечто среднее между термическим методом, где используется металл, и методами, в которых применяются соли металла и циклопентадиенил-анионы. [1]
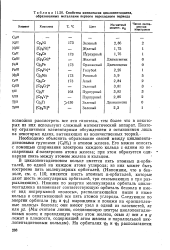 |
Свойства комплексов циклопентадиена, образованных металлами первого переходного периода. [2] |
В циклопентадиеновом кольце имеется пять атомных я-орби-талей, по одной на каждом атоме углерода; из них может быть построено пять молекулярных орбиталей. [3]
Благодаря наличию циклопентадиенового кольца флуорен легко вступает во многие реакции, характерные для этой циклической системы. [4]
Благодаря наличию циклопентадиенового кольца флуорен легко вступает о многие реакции, характерные для этой циклической системы. [5]
Связь между металлом и циклопентадиеновыми кольцами включает я-элек-троны обоих колец; таким образом, все углеродные атомы в равной степени связаны с центральным ионом железа. Последний, участвуя в образовании связей с двенадцатью я-электронами двух циклопентадиенильных анионов, приобретает электронную конфигурацию инертного газа криптона. [6]
Связь между металлом и циклопентадиеновыми кольцами включает я-электроны обоих колец; таким образом, все углеродные атомы в равной степени связаны с центральным ионом железа. Последний, участвуя в образовании связей с 12я - электронами двух цик-лопентадиенильных анионов, приобретает электронную конфигурацию инертного газа криптона. [7]
Наличие дополнительных двойных связей при циклопентадиеновом кольце, как в фульвенах или циклопентадиенонах, по-видимому, допускает образование устойчивых металлических комплексов, в которых циклопентадиенильный остаток сохраняет свой сопряженный характер. [8]
Как и в предыдущей молекуле, циклопентадиеновое кольцо неплоское, причем плоскость группы С-СО-С образует с плоскостью четырех атомов углерода цикла ( в этой же плоскости лежат атомы углерода трифторметильных групп) угол 21 3, а связь углерод - кислород образует угол 8 с плоскостью атомов углерода группы С-СО-С, отклоняясь еще дальше от атома кобальта. [9]
В молекуле азулена водородному обмену подвержены два атома водорода циклопентадиенового кольца, что также соответствует сказанному выше [ A. [10]
Наличие в ( I) по соседству с трехчленным циклом системы двойных связей циклопентадиенового кольца позволяет предположить у этого соединения ряд интересных свойств, заслуживающих дополнительного изучения. В такой системе можно ожидать и сопряжения своеобразного л-облака трехчленного цикла с двойными связями [4] и образования квазиароматической системы в том случае, если это я-облако способно замыкать систему я-электронов пятичленного кольца. [11]
Это подтверждается малой длиной ( 1 38 А) связи 3 4 в циклопентадиеновом кольце и отклонением ( 36 от атома кобальта) Сг от плоскости кольца. Расстояние кобальт - Cj было найдено равным 2 55 А, по сравнению со средним расстоянием кобальт - углерод 2 01 А для остальных четырех углеродных атомов этой системы. Среднее расстояние кобальт-углерод в я-циклопентадиенильном кольце 2 06А, что указывает на несколько более слабое связывание, чем для циклопентадиена с металлом. [12]
Это подтверждается малой длиной ( 1 38 А) связи 3 4 в циклопентадиеновом кольце и отклонением ( 36 от атома кобальта) Сх от плоскости кольца. Расстояние кобальт - Cj было найдено равным 2 55 А, по сравнению со средним расстоянием кобальт - углерод 2 01 А для остальных четырех углеродных атомов этой системы. Среднее расстояние кобальт-углерод в л-циклопентадиенильном кольце 2 06А, что указывает на несколько более слабое связывание, чем для циклопентадиена с металлом. [13]
Не менее интересен и другой фторированный комплекс кобальта - молекула перфторциклопентадиендиксбальт-геп-такарбонила C5F6Co2 ( CO) 7, в которой i [142] фторированное циклопентадиеновое кольцо объединяет фрагменты Со ( СОц и Со ( СО) 3, образуя с первым а-связь длиной 1 97 А и координируя второй л-аллильной системой ( рис. 226) на расстояниях Со-С 1 91 - 2 04 А. Оба атома Со имеют тригонально-бипирамидальное окружение лигандами. [14]
Можно, по-видимому, весьма определенно утверждать, что титан способен образовывать или локализованные ковалентные связи с углеродом ( стабильность которых ограничена, как в фенильных соединениях, о которых шла речь выше), или дело-кализованные d - орбитальные связи с циклопентадиеновыми кольцами, обладающие замечательной стабильностью. Оно менее устойчиво, чем галоге-ниды этого иона, и при комнатной температуре медленно ( а при 105 очень быстро) разлагается, образуя бензол и другие продукты. Из смеси петролейного эфира и хлористого метилена это вещество кристаллизуется в виде кристаллов желто-оранжевого цвета. При помощи подобных же препаративных методов получены и выделены аналогичные соединения - ди-п-толил-быс - циклопентадиенилтитан и быс-п-диметиламинофенил-бис - цикло-пентадиенилтитан [11], которые также представляют собой кристаллические вещества. Дифенильное соединение ( и, предположительно, остальные также) в свою очередь реагирует с фенил-литием в эфирном растворе, давая растворимый, но не охарактеризованный подробно анион ( CeHsbfCgHsbTr, из которого в результате гидролиза можно опять получить дифенил-бцс-циклопентадиенилтитан. [15]
Страницы: 1 2