Комплекс - ион - медь
Cтраница 1
Комплекс иона меди ( П) с тартрат-ионом С4Н40 - в щелочном растворе используют как реактив ( фелингова жидкость) для определения органических восстановителей, например некоторых Сахаров. Этот реагент применяют для определения содержания сахара в моче при диагностировании диабета. [1]
Вторичными продуктами коррозии являются сложные гидратно-карбонатные комплексы ионов меди и цинка. Углекислотная коррозия чаще всего имеет место в подогревателях, охладителях пара эжекторов конденсаторов турбин и других теплообменных аппаратов, где происходит конденсация пара, содержащего избыточную угольную кислоту. [2]
Таким образом, общая скорость обмена в комплексах ионов меди ( II) с этилендиамином представляется складывающейся из двух компонентов, из которых первый определяется изменением концентрации лиганда, непосредственно участвующего в образовании комплекса, второй компонент связан с реакцией обмена аминных протонов лиганда, катализируемой щелочью. [3]
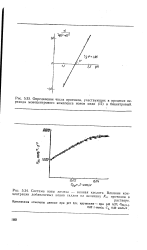 |
Система ионы железа - винная кислота. Влияние концентрации добавляемых ионов галлия на величину Ля. протонов в. [4] |
Определение числа протонов, участвующих в процессе перехода моноцентрового комплекса ионов меди ( II) в бицентровый. [5]
Это наглядно проявилось при исследовании кинетики обмена в комплексах ионов меди ( II) с моно-этаноламином. На рис. 5.42 представлена зависимость / Сэ2 от рН в растворах комплексов ионов меди ( II) при постоянной избыточной концентрации моноэтаноламина. Результаты показывают, что величина / СЭ2 с увеличением рН первоначально резко возрастает, при рН - 10 проходит через максимум и затем падает. [6]
В данном разделе рассмотрено влияние некоторых анионов ( S203 -, P2O7 -, С2О4 - -, лактат-ионов), входящих во внутреннюю сферу комплексов ионов меди ( II), на скорости обмена молекул этилендиамина и моноэтаноламина. Во всех изученных нами смешанных комплексах ионов меди ( II) с аминами измеряемый на опыте коэффициент спин-спиновой релаксационной эффективности контролируется скоростью химического обмена молекул аминов внутренней сферы комплекса с аминами в массе раствора. [7]
В щелочной среде раствор белка при добавлении разбавленного раствора сульфата меди окрашивается в сине-фйолетовый цвет. Окраска обусловлена образованием комплексов ионов меди с пептидными группами белка. [8]
Это наглядно проявилось при исследовании кинетики обмена в комплексах ионов меди ( II) с моно-этаноламином. На рис. 5.42 представлена зависимость / Сэ2 от рН в растворах комплексов ионов меди ( II) при постоянной избыточной концентрации моноэтаноламина. Результаты показывают, что величина / СЭ2 с увеличением рН первоначально резко возрастает, при рН - 10 проходит через максимум и затем падает. [9]
Предполагается, что вакантные координационные положения металла заняты молекулами воды. Первые хелатные соединения были открыты Вернером еще в 1901 г., однако особенности их строения оставались неясными вплоть до 1904 г., когда Лей изучил хелатный комплекс иона меди и глицина. [10]
Ряд химических превращений, связанных с образованием окрашенных растворов и садков, имеет широкое применение в области качественного химического, анализа. Достаточно указать на столь чувствительную реакцию для открытия иона железа, как образование недиссоциированного окрашенного в красный цвет роданида железа, растворимого в воде и а этиловом эфире, или на реакцию образования темносинего комплекса иона меди при взаимодействии водного раствора аммиака с растворами солей меди. [11]
Постоянство измеряемого параметра ( АТг) 1 в этом случае предполагает сохранение механизма лигандного обмена и в сильнощелочных средах, а неизменность ( NTi) указывает, согласно теории релаксации в парамагнитных растворах, на то, что ион гидроксила не входит в первую сферу. Постоянство состава первой координационной сферы в этих экспериментах подтверждается также исследованиями спектров ЭПР и спектров поглощения в видимой области. Можно считать, что в изученном интервале щелочности смешанные гидроксилсодержащие комплексы ионов меди ( II) с моноэтаноламином, а также смешанные комплексы ионов меди ( II) с серином в заметных количествах в растворе не накапливаются. Из полученных данных следует также, что в изученной области изменения щелочности раствора ускорение протонного обмена, катализируемого щелочью, наблюдается только в растворах комплексов ионов меди ( II) с этилен-диамином и, по-видимому, с аспарагином. Причина такого различия в подвижностях аминных протонов координированных лигандов в сильнощелочных средах кроется, по-видимому, в характерах связей медь - азот и медь-кислород. [12]
В случае хелатных циклов с металлами с различающимися типами связей, например хелатов меди ( II) с кислород - и азотсодержащими соединениями, эффективность рассматриваемого процесса будет зависеть от под-вижностей координирующих групп лиганда, в состав которых входят протоны. Отсюда следует, что быстрое раскрытие циклов по связям медь-кислород не должно ускорять реакцию протонного обмена [ комплексы ионов меди ( II) с моноэтано-ламином и серином ], в то время как любые раскрытия хелатных циклов с металлом в комплексах с этилендиа-мином оказываются эффективными в обмене протонами. В пользу этого механизма говорит также наблюдаемое небольшое ускорение протонного обмена в комплексах ионов меди ( II) с аспарагином ( см. табл. 5.19), где имеется тот же фрагмент двух связей медь - азот, что и в комплексах с этилендиамином. Однако в комплексе с аспарагином большая жесткость всего хелатного цикла с металлом должна затруднять обмен за счет раскрытия цикла, и катализ следует ожидать в более щелочных областях, что и наблюдается в эксперименте. [13]
В случае хелатных циклов с металлами с различающимися типами связей, например хелатов меди ( II) с кислород - и азотсодержащими соединениями, эффективность рассматриваемого процесса будет зависеть от под-вижностей координирующих групп лиганда, в состав которых входят протоны. Отсюда следует, что быстрое раскрытие циклов по связям медь-кислород не должно ускорять реакцию протонного обмена [ комплексы ионов меди ( II) с моноэтано-ламином и серином ], в то время как любые раскрытия хелатных циклов с металлом в комплексах с этилендиа-мином оказываются эффективными в обмене протонами. В пользу этого механизма говорит также наблюдаемое небольшое ускорение протонного обмена в комплексах ионов меди ( II) с аспарагином ( см. табл. 5.19), где имеется тот же фрагмент двух связей медь - азот, что и в комплексах с этилендиамином. Однако в комплексе с аспарагином большая жесткость всего хелатного цикла с металлом должна затруднять обмен за счет раскрытия цикла, и катализ следует ожидать в более щелочных областях, что и наблюдается в эксперименте. [14]
Постоянство измеряемого параметра ( АТг) 1 в этом случае предполагает сохранение механизма лигандного обмена и в сильнощелочных средах, а неизменность ( NTi) указывает, согласно теории релаксации в парамагнитных растворах, на то, что ион гидроксила не входит в первую сферу. Постоянство состава первой координационной сферы в этих экспериментах подтверждается также исследованиями спектров ЭПР и спектров поглощения в видимой области. Можно считать, что в изученном интервале щелочности смешанные гидроксилсодержащие комплексы ионов меди ( II) с моноэтаноламином, а также смешанные комплексы ионов меди ( II) с серином в заметных количествах в растворе не накапливаются. Из полученных данных следует также, что в изученной области изменения щелочности раствора ускорение протонного обмена, катализируемого щелочью, наблюдается только в растворах комплексов ионов меди ( II) с этилен-диамином и, по-видимому, с аспарагином. Причина такого различия в подвижностях аминных протонов координированных лигандов в сильнощелочных средах кроется, по-видимому, в характерах связей медь - азот и медь-кислород. [15]
Страницы: 1