Комплекс - лантаноид
Cтраница 2
 |
Некоторые типы полиэдров, отвечающих характерным координационным числам лантаноидов ( III. [16] |
Ион [ Ce ( NO3) 6 ] 3 - имеет форму двенадцативершинника ( икосаэдр), ион [ Ce ( NO3) 6 ] 2 - - форму десятивершинника, а ион 1Mb ( ОН2) 9 ] 3 -девятивершинника. Весьма разнообразны комплексы лантаноидов с лигандами хелатного типа. [17]
Ион [ Ce ( NO3) 6 ] 3 - имеет форму двенадцативершинника ( по атомам О), ион [ Се ( МО3) 512 - - форму десятивершинника, а ион [ Nd ( OH2) 9 ] 3 - девятивершинника. Весьма разнообразны комплексы лантаноидов с лигандами хелатного типа. [18]
Следует указать на очень большие различия в величинах констант устойчивости, приводимых различными авторами для одного и того же комплекса. Неправильно определены константы устойчивости комплексов лантаноидов с ПАР [180]: lg p 2 69 - - 3 81; авторы считали, что комплексообразование протекает по n - оксигруппе, а не по о-оксигруппе. Эти различия отчасти обусловлены неправильно найденным соотношением компонентов в комплексе, выбранной схемой комплексообра-зования, использованием термодинамических, а не условных констант диссоциации реагентов, без учета природы растворителя и диэлектрической проницаемости среды. [19]
При 200 С давление паров комплексов лантаноидов с дипивалоилметаном изменяется от 5 до 0 5 мм рт. ст. Высокая летучесть комплексов объясняется тем, что большие по размеру лиганды образуют углеводородную оболочку, защищающую полярные группы от взаимодействия с соседними молекулами. Вследствие лантаноидного сжатия защитная оболочка окатывается более компактной при увеличении атомного номера лантаноида, что приводит к увеличению летучести хелатов с ростом порядкового номера металла. Различие в давлении паров хелатов лантаноидов позволяет разделять их смеси методом газовой хроматографии. [20]
Чем больше константа устойчивости комплекса Ьп ( НА2) з, тем сильнее сдвинуто вправо равновесие ( 2) и, следовательно, выше концентрация экстрагируемого соединения в водной фазе я, таким образом, выше коэффициент ( распределения. Экспериментальные данные по константам устойчивости комплексов лантаноидов с Д2ЭГФК и другими экстрагентами этого класса в литературе отсутствуют. Однако, поскольку коэффициент распределения ( который пропорционален константе устойчивости комплекса) очень сильно увеличивается с ростом Z, можно предположить, что такие комплексы достаточно устойчивы. Этот вывод следует из анализа экспериментальных данных по константам устойчивости комплексов лантаноидов с другими лигандами в водных растворах, которые в общем случае тем существеннее увеличиваются с ростом Z, чем их значения выше. [21]
У комплексов двухвалентных металлов этот эффект возникает при рН 3 и рН 10, и его численная величина очень мала. То же самое имеет место для комплексов лантаноидов и актиноидов. Комплексы А1Ш, уш, Fe111, Bi, Gani, Inm, T1IV, Thiy значительно более кислые [ 49 ( 1) ] и присоединяют гидроксильную группу уже в нейтральном растворе. Ионы этих многовалентных металлов, комплексы которых характеризуются очень большими величинами констант устойчивости ( / ( MY 1020), всегда титруют в сильнокислой среде, так как вследствие гидролиза только в таких условиях не связанный с хелатообразующим веществом металл может существовать в виде свободного катиона. [22]
При выводе этих соотношений предполагалось также, что в водной фазе отсутствуют заметные количества комплексов лантаноидов с экст-рагентом и что в органической фазе присутствует только один комплекс. [23]
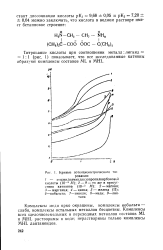 |
Кривые потенциометрического тш. [24] |
Комплексы меди ярко окрашены, комплексы кобальта - слабо, комплексы остальных металлов бесцветны. Комплексы всех щелочноземельных и переходных металлов составов ML и MHL растворимы в воде; нерастворимы только комплексы MHL лантаноидов. [25]
Это связано с тем, что внешние 5з2р6 - электроиы сильно экранируют / - оболочку от действия лигандов. В то же время внешние электроны мешают образованию л-связей лигандов с / - электронами, связь металл - лиганд здесь существенно ионная, и теория кристаллического поля хорошо описывает наблюдаемые для комплексов лантаноидов закономерности. [26]
Однако в это время авторы данного сообщения) [3] при изучении экстракционно-хроматогр афического разделения лантаноидов с помощью ЭГФФК обнаружили новый эффект, названный регулярностью IB константах устойчивости. Этот эффект проявляется в существовании определенной последовательности четырех минимумов и четырех максимумов на зависимости факторов разделения от порядкового номера в лантаноидном ряду. Авторы интерпретировали этот эффект как общую закономерность IB поведении комплексов лантаноидов и продемонстрировали его, определив наклоны зависимостей р от Z, Позднее Пеппард и др. пришли к выводу, что их данные по экстракции лантаноидов кислотными фосфорор - ганическими соединениями подчиняются закономерности, обнаруженной для ЭГФФК. [27]
Чем больше константа устойчивости комплекса Ьп ( НА2) з, тем сильнее сдвинуто вправо равновесие ( 2) и, следовательно, выше концентрация экстрагируемого соединения в водной фазе я, таким образом, выше коэффициент ( распределения. Экспериментальные данные по константам устойчивости комплексов лантаноидов с Д2ЭГФК и другими экстрагентами этого класса в литературе отсутствуют. Однако, поскольку коэффициент распределения ( который пропорционален константе устойчивости комплекса) очень сильно увеличивается с ростом Z, можно предположить, что такие комплексы достаточно устойчивы. Этот вывод следует из анализа экспериментальных данных по константам устойчивости комплексов лантаноидов с другими лигандами в водных растворах, которые в общем случае тем существеннее увеличиваются с ростом Z, чем их значения выше. [28]
Страницы: 1 2