Перекисный комплекс - титан
Cтраница 1
Хорошо известные перекисные комплексы титана прочно удерживаются катионитами. Медведева [5 ] разработали метод отделения титана от ниобия, основанный на селективном поглощении титана из 0 5 - 0 7Ж раствора соляной кислоты, содержащего 0 5 % перекиси водорода. Отделение титана от ванада-тов, молибдатов и вольфраматов выполняется при рН 5 в присутствии перекиси водорода, которая, помимо своей основной функции, препятствует восстановлению указанных анионов. [1]
Хорошо известный желтый перекисный комплекс титана достаточно легко поглощается сульфокатионитом в Н - форме и окрашивает его частицы в желтый цвет. Здесь, как и в большей части других капельных проб, предпочтительно пользоваться ионитом с низкой степенью поперечной связанности. Для определения некоторое количество зерен ионита смешивают с каплей кислого анализируемого раствора и каплей 0 2Af раствора НС1 на белой фарфоровой пластинке для капель. Добавление одной капли перекиси водорода вызывает желтое окрашивание. Предел обнаружения 0 25 мкг титана; чувствительность понижается в присутствии фосфорной кислоты. Существенно мешает также хром, но он может быть удален посредством анионообменного разделения после предварительного окисления в хромат. Мешающий определению фтор-ион может быть замаскирован добавлением хлористого бериллия. [2]
Метод заключается в том, что колориметрируют перекисный комплекс титана на фоне раствора, содержащего известное количество титана. [3]
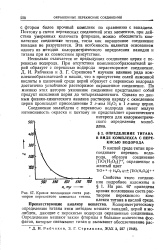 |
Кривая поглощения света раствором перекисного комплекса титана. [4] |
На рис. 67 приведена кривая поглощения света раствором перекисного комплекса титана в кислой среде. [5]
Так, систему титан - ксиленоловый оранжевый ( КО) нельзя использовать в качестве металл-индикатор ной для изучения перекисных комплексов титана, потому что Ti КО взаимодействует с Н2О2 с образованием тройных комплексов. Система 1п3 - пирокатехиновый фиолетовый ( ПКФ) служит хорошим индикатором для изучения фторидного, щавелевокислого и других комплексов индия, но непригодна для изучения его аминных комплексов, так как в системе In-ПКФ-Am образуются тройные комплексы. [6]
Из фотометрических методов определения перекиси водорода наиболее широко известен так называемый титановый метод [26-30], по которому в сернокислой среде образуется оранжево-желтый перекисный комплекс титана. Окраска комплекса устойчива, но метод не отличается чувствительностью ( см. Определение титана, стр. [7]
По Шрайеру механизм снижения наводороживания в процессе кадмирования объясняется образованием промежуточного слоя окиси титана, который препятствует наводороживанию стали. Для формирования такого слоя необходимо мгновенное увеличение плотности тока до 100 мА / см2, что одновременно облегчает восстановление перекисного комплекса титана, снижает скорость выделения водорода и препятствует проникновению его в сталь. [8]
Среди прочих оксисоединений, применяемых в качестве аналитических реагентов на титан, особого внимания заслуживает хромотроповая кислота. Молярный коэффициент погашения комплекса, образуемого титаном с хромотроповой кислотой, согласно данным А. К. Бабко и П. В. Ходулиной [4], примерно в 100 раз выше, чем перекисного комплекса титана. [9]
Берут две мерные колбы емкостью 25 мл, в одну из них наливают испытуемый раствор, содержащий 5 - 100 мкг фтора, затем в обе колбы наливают по 5 мл приготовленного раствора перекисного комплекса титана. Оба раствора разбавляют водой до метки и перемешивают. Приготовленные растворы наливают в кюветы и измеряют оптическую плотность раствора сравнения по сравнению с исследуемым раствором при 400 нм. [10]
Готовят окрашенный раствор сульфата титана, как указано в гл. Берут две мерные колбы емкостью 50 мл, в одну из них наливают испытуемый раствор, содержащий от 0 01 до 0 2 мг фтора, затем в обе колбы наливают по 10 мл приготовленного раствора перекисного комплекса титана. Оба раствора разбавляют водой до метки и хорошо перемешивают. Их наливают в кюветы и измеряют уменьшение интенсивности окраски. [11]
Определение компонентов ведут из одной навески. Висмут определяют также комплексоно-метрически при рН 1 - 2 с индикатором ксиленоловым оранжевым. Титан определяют фотометрически измерением эк-стинкции перекисного комплекса титана, образуемого в кислой среде. Метод позволяет определять стронций с погрешностью не более 0 6 %, висмут - 0 4 % и титан - 1 % отн. [12]
Комплексы оснований с ацидо-кислотами металлов применяют для определения Си в виде пиридин-роданидного комплекса, Ti в виде диантипирилметац-роданидиого комплекса и др. Обо последние группы обычно применяют в К. Комплексы металлов с органич. Окислительно-восстановительные реакции, напр, определение Мп в виде перманга-ната, и др. 8) Для определения анионов применяют часто реакции обесцвечивания ими окрашенных комплексов металлов; так, для определения фторид-ионов измеряют ослабление окраски растворов перекисного комплекса титана вследствие связывания титана во фторидный комплекс. Применяют также реакции синтеза; напр. Кроме обычных типов реакций комплексо-образования, окисления-восстановления и синтеза, используются также каталитпч. [13]
Если два раствора какого-либо окрашенного соединения, находясь в аналогичных условиях, имеют одинаковую окраску, то концентрации компонента, обусловливающего эту окраску, равны. Колориметрические определения и основаны на уравнивании интенсивности окрасок испытуемого и так называемого стандартного раствора, содержащего определяемый компонент в известной концентрации. В колориметрическом анализе используют, в большинстве случаев, реакции образования окрашенных комплексных соединений. Например, ион трехвалентного железа действием иона CNS - переводят в комплекс [ Fe ( CNS) ] темно-красного цвета. Элемент титан определяют в виде комплексного иона [ ТЮ ( Н2О2) ], имеющего желтый цвет. Перекисный комплекс титана образуется при взаимодействии иона ТЮ с перекисью водорода в присутствии азотной или серной кислоты. При действии на ион меди дифенилтиокарбазоном ( дитизон) получается комплекс фиолетового цвета. Элемент кремний определяют в форме гетерополикислоты желтого цвета. [14]
Страницы: 1