Бромидный иодидной комплекс
Cтраница 1
Бромидные и иодидные комплексы близки к хлоридным и обычно имеют аналогичные формулы. [1]
Бромидные и иодидные комплексы также экстрагируются кислородсодержащими растворителями, но практическое значение этих систем значительно меньше, чем хлоридных. [2]
 |
Библиография работ по экстракции роданистоводородвоЕ кислоты. [3] |
Фторидные, хлоридные, бромидные и иодидные комплексы можно экстрагировать из растворов соответствующих кислот, роданидные комплексы всегда извлекают из растворов роданидов щелочных металлов или аммония, в которые вводят то или иное количество минеральной кислоты, например серной или соляной. Связано это не только с тем, что роданистоводородная кислота в чистом виде неустойчива, но и с большей свободой маневра, которую представляет независимое регулирование концентрации роданидного и водородного иона. [4]
В случае бромидных и иодидных комплексов должно происходить растяжение каркаса и, следовательно, увеличение энергии иона в растворе, что облегчает его экстракцию. Вода в координационной сфере комплексного иона легко входит в каркас кубического льда и прочно с ним связывается. [5]
В табл. 3 приведены найденные Леденом значения общих констант устойчивости хлоридных, бромидных и иодидных комплексов кадмия. [6]
Результаты для хлоридных и бромидных комплексов индия, полученные различными методами, практически совпадают. Устойчивость хлоридных, бромидных и иодидных комплексов индия определена [145] при помощи катионита с высокой емкостью ( в Н - форме) при 20, концентрации галогенида ниже 0 5 молъ / л и постоянной ионной силе, равной 0 691, поддерживаемой при помощи НСЮ, с использованием радиоактивного изотопа индия. [7]
Из табл. 68 и 70 видно, что устойчивость комплексов гафния типа HfX3 ( по-видимому, и циркония) уменьшается с ростом атомного номера галогена в ряду F C1 Вг I. Устойчивость иона HfF3 примерно на восемь порядков больше, чем устойчивость таких же хлоридных, бромидных и иодидных комплексов гафния, что, возможно, связано с различным типом связи гафний - галоген в этих соединениях. [8]
В воде легко образуются фторидные, азидные, цианидные и тиоцио-натные комплексы металлов класса а, поскольку донорные свойства воды ниже, чем конкурирующих лигандов. С другой стороны, вода как растворитель служит плохой реакционной средой для образования хлоридных, бромидных и иодидных комплексов металлов класса а. Некоторые из них образуются только при наличии большого избытка конкурирующего лиганда, другие в воде вообще не образуются. [9]
Целесообразно оценить экстракцию галогенидов и псевдога-логенидов с точки зрения относительной распространенности и важности отдельных экстракционных систем. Наибольшее значение в настоящее время имеет экстракция хлоридов и родани-дов. Экстракция бромидных и иодидных комплексов применяется почти исключительно в лабораторных условиях, но для аналитической химии служит весьма полезную службу. Так, индий и золото часто извлекают в виде бромидов, мышьяк, сурьму, таллий, индий, олово - в виде иодидов. Цианиды слишком ядовиты, чтобы привлекать внимание химика-практика, к тому же некоторые цианидные комплексы, которые очень прочны и имеют другие достоинства, являются, к сожалению, многозарядными, а поэтому плохо экстрагируются. Широкое использование хлоридных комплексов связано прежде всего с доступностью соляной кислоты, ибо по чисто экстракционным характеристикам хлориды отнюдь не выделяются среди других галогенидов. Роданидные комплексы весьма интересны и использование их должно расширяться; нужно только глубже исследовать механизм экстракции этих соединений. [10]
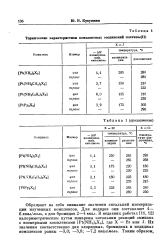 |
Терияческие характеристики комплексных соединений платины ( Н. [11] |
Обращают на себя внимание значения энтальпий изомеризации изученных комплексов. Для иодидов они составляют 4 - 6 ккал / молъ, а для бромидов 2 - 4 ккал. В недавних работах [11, 12] калориметрическим путем измерены энтальпии реакций аммиака с изомерными комплексами [ Pt ( NH3) 2X2 ], где X Вг или J. Иг значения соответственно для хлоридных, бромидных и иодидных комплексов равны - 3 0; - 3 8; - 7 2 ккал / молъ. [12]
Однако в большинстве случаев эти методы мало специфичны, так как применяющиеся реактивы образуют экстрагирующиеся комплексы со многими другими металлами. И в этом случае специфичность невысокая, поскольку многие металлы также образуют экстрагирующиеся иодидные комплексы. Большей специфичности можно ожидать в случае экстракции хлоридных комплексов, так как хлорид-ионы менее склонны к образованию комплексов с металлами. В настоящей работе приводятся данные об экстракции хлоридных, бромидных и иодидных комплексов висмута. [13]
Страницы: 1