Константа - скорость - образование
Cтраница 1
 |
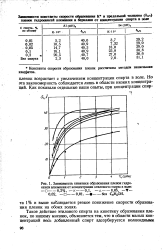
Зависимость концентрации двуокиси углерода ( в стехиометрической смеси окиси углерода и кислорода от времени циркуляции газа при 20, Рнач 300 нал рт. ст. и разных. [1] |
Константы скорости образования и диссоциации С02 практически не зависели от концентрации Аг в исходной смеси. При добавках Не константы скорости диссоциации С02 k0 значительно уменьшились, в то время как константы скорости образования С02 k почти не менялись. При добавках азота обе константы, увеличивались, таким образом азот является энергетическим катализатором этих реакций. При больших концентрациях азота, по-видимому, происходит рекомбинация атомов кислорода с участием образующихся окислов азота ( см. стр. [2]
Константа скорости образования HCN из азота и этилена ( изменение числа молекул HCN в 1 см3) составляет107 108 3 0 - 10 - 14, а энергия активации равна 1500 200 кал / моль. [3]
 |
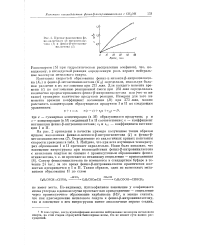
Зависимость кинетики образования плевок гидроокиси алюминия от концентрации этилового спирта в золе. [4] |
Константы скорости образования пленок рассчитаны методом наименьших квадратов. [5]
 |
Кривые накопления фе. [6] |
Константы скоростей образования фенил-а-метокси-р - нитроэтилкето-на ( Кг) и фенил-р-метоксивинидкетона ( Кп) определяли, используя большое различие в их поглощении при 273 ммк. Для каждого момента времени ( t) по поглощению реакционной смеси при 232 ммк определялось количество прореагировавшего фенил - 3-нитровинилкетона или ( что то же самое) суммарное количество продуктов реакции. [7]
Константа скорости образования зародышей kt должна быть очень велика для того, чтобы уравнение ( 82) могло быть применено вплоть до периода затухания скорости разложения; к последнему периоду уравнение ( 80) неприменимо, поскольку при его выводе мы полностью пренебрегли взаимодействием зародышей. [8]
Константы скоростей образования димеров и полимеров молекул UFs не сильно отличаются друг от друга, в то время как константа скорости обратной рекомбинации атомов фтора с мономерами пентафторида урана превосходит аналогичную константу с полимерами UFs B 25 раз. Это обстоятельство, как будет показано ниже, играет определяющую роль в ограничении процесса обратной рекомбинации. [9]
Если константы скоростей образования и разложения промежуточного соединения с субстратом различны, то измеряя нормальные окислительные потенциалы субстрата, образующейся системы и катализатора, можно определить по уравнению ( IV. Таким образом, измерения окислительного потенциала могут служить одним из методов изучения механизма каталитических реакций. [10]
Если константы скорости образования и разложения промежуточного соединения субстрата с катализатором различны, то, измеряя нормальные окислительные потенциалы субстрата, образующейся системы и катализатора, можно по уравнениям ( 5) - ( 7) определить соотношение констант скоростей образования и распада промежуточного соединения. Таким образом, измерение окислительного потенциала может быть одним из методов изучения механизма каталитических реакций. [11]
А Константа скорости образования дейтеробутанов ( любой степени дейтерирования) пропорциональна числу активных центров. [12]
Уменьшение констант скоростей образования и диссоциации по мере повышения концентрации СО в смесях с 02 или С02 показывает, что в обеих реакциях СО не участвует в первичных процессах. [13]
Различие констант скоростей образования отдельных изомеров может определяться в общем случае как различием факторов, не зависящих от температуры, так и различием в энергиях активации. Экспериментально установлено, что при реакции замещения в ароматическом ряду, как правило, разница в скоростях реакции образования отдельных изомеров обусловливается только различием энергий активации. Так, при нитровании толуола наименьшая энергия активации отмечена для реакции образования пара-изомера 20, наибольшая - для образования мета-изомера. В то же время фактор, не зависящий от температуры, здесь одинаков. [14]
Различие констант скоростей образования отдельных изомеров может определяться в общем случае как различием факторов, не зависящих от температуры, так н различием в энергиях активации. Экспериментально установлено, что при замещении в ароматическом ряду, как правило, разница в скоростях реакции образования отдельных изомеров обусловливается только различием энергий активации; не зависящие от температуры факторы констант скоростей замещения в различных положениях к заместителю практически одинаковы. [15]
Страницы: 1 2 3 4