Константа - скорость - первый порядок
Cтраница 2
Отношение константы скорости первого порядка внутримолек лярной реакции к константе скорости второго порядка соответс; вующей бимолекулярной реакции, протекающей по подобном механизму, позволяет оценить эффективность внутримолекуляр ного процесса. Это отношение ki / ft2 ( моль / л) имеет разме ность молярной концентрации и часто называется эффективнс молярностью. Формально эта величина является той концентр; цией реагента, например Б, в бимолекулярной реакции, которг требуется для того, чтобы константа скорости псевдопервого ш рядка межмолекулярной реакции была равна константе скорое. Наивысший предел концентраци которую можно создать, не превышает 102 моль / л и достигаете если Б является растворителем, в котором проводится реакци Например, концентрация воды в воде 55 5 моль / л, а метано. Можно подсчитать, что такое увеличен) концентрации должно приводить к выигрышу в энергии актив ции Гиббса внутримолекулярной реакции в 8 - 12 кДж / моль. Де ствительно, в ряде реакций, протекающих внутримолекулярн порядок ускорения таков, что его можно связать преимуществен. [16]
При этом константа скорости первого порядка зависит от природы нитруемого соединения. Если же нитруемое соединение является вькхжорсакционноспособным. HsNO Поэтому константа скорости реакции в этом случае не зависит от природы нитруемого соединения, а порядок реакции является нулевым. [17]
Так как константа скорости первого порядка имеет размерность сек. Под знаком логарифма в формуле для этой константы стоит отношение двух концентраций, величина которого и определяет значение константы. [18]
& - кажущая константа скорости первого порядка, & buffer - константа скорости первого порядка в буферной смеси в отсутствии третичного амина. [19]
Верхний предел констант скорости первого порядка, которые можно наблюдать данным методом, приблизительно представляет собой обратную величину минимального измеримого периода полупревращения. В табл. 1 даны максимальные константы второго порядка, которые можно наблюдать каждым методом. Следует отметить, что для многих методов эта величина имеет порядок 109 л-моль 1 сек 1 или больше, хотя для некоторых из них минимальный наблюдаемый период полупревращения не менее 10 - 4 сек. В табл. 1 также указаны нижние пределы. [20]
Вычислите отношение констант скоростей первого порядка & А / & В, необходимое для того, чтобы за определенный промежуток времени прореагировало 99 9 % соединения А п только 0 1 % соединения В. [21]
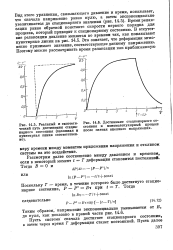
Время релаксации равно обратной константе скорости первого порядка для процесса, который приводит к стационарному состоянию. В отсутствие релаксации давление меняется во времени так, как показывают пунктирные линии на рис. 14.5. Это означает, что деформация мгновенно принимает значение, соответствующее данному напряжению. [23]
Время релаксации равно обратной константе скорости первого порядка для процесса, который приводит к стационарному состоянию. В отсутствие релаксации давление меняется во времени так, как показывают пунктирные линии на рис. 14.5. Это означает, что деформация мгновенно принимает значение, соответствующее данному напряжению. [25]
В чистом этане константа скорости первого порядка в начале процесса уменьшается с понижением давления. Заксе [47] нашел, что при 38мм рт. ст. скорость равна половине предельной скорости при высоком давлении. [26]
Кроме того, константа скорости первого порядка не изменяется пропорционально концентрации катализатора. Именно этот эффект и будет рассмотрен в первую очередь. [27]
В чистом этане константа скорости первого порядка в начале процесса уменьшается с понижением давления. Заксе [47] нашел, что при 38мм рт. ст. скорость равна половине предельной скорости при высоком давлении. [28]
При сделанных допущениях измеряемая константа скорости первого порядка равна произведению К А. Ед, где Е - энергия активации реакции на поверхности, входящая в k EA - теплота адсорбции А. [29]
Подобным образом [59] константа скорости первого порядка разложения лауроилперекиси ( концентрация 0 2 М) при 30 С равна 2 5 10 - 7 с 1 в бензоле, но. Реакции в быстрых растворителях тормозятся кислородом и ингибиторами. Следовательно, индуцированное разложение должно быть цепным процессом. [30]
Страницы: 1 2 3 4