Константа - скорость - процесс
Cтраница 2
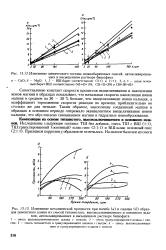
Константу скорости процесса окисления S02 на ванадиевом катализаторе или время контакта рекомендуется [162, 187, 248] рассчитывать на основе уравнения Борескова. При х 0 6 можно принять, что суммарное воздействие проскока пузырей и перемешивания газа соответствует полному смешению. [16]
Если константа скорости процесса очень велика, то в знаменателе выражения (6.75) можно пренебречь Д0х и уравнение сводится к зависимости (6.72), описывающей предельный ток процесса, контролируемого только скоростью массопереноса. [17]
Значения констант скорости процесса, вычисленные с учетом и без учета изменения объема газа за счет реагирования, различаются между собой. [18]
Зависимость константы скорости процесса от температуры в координатах gk от 1 / Г выражается прямой. [19]
Увеличение константы скорости процесса ( коэффициента массопередачи) может достигаться, в основном, тремя путями: i) повышением температуры взаимодействующей системы; 2) применением катализаторов для процессов, протекающих в кинетической области; 3) усилением перемешивания реагирующих масс ( турбулизацией системы) в процессах, лимитируемых межфазным переносом. [20]
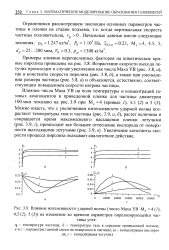 |
Влияние интенсивности ударной волны ( число Маха УВ М5 4 ( /. [21] |
Увеличение константы скорости процесса пиролиза оказывает аналогичное действие. [22]
Сравнением констант скорости внешнедиффузионного процесса с константами скорости внутридиффузионного процесса найдено, что в изученном интервале изменения концентрации раствора и при постоянстве других параметров скорость обмена Na - Cs контролируется различными механизмами: внутридиффузионным, смешанным и внешнедиффузион-ным, тогда как скорость обмена Na - К и Na - Li контролируется только внутридиффузионным механизмом, хотя при более низких концентрациях внешнего раствора также может лимитироваться смешанным или внешнедиффузионным механизмами. С увеличением размера проти-воиона граница перехода между механизмами, контролирующими скорость ионообменного процесса, смещается в сторону более концентрированных растворов. Это объясняется тем, что имеющее место увеличение константы скорости внешнедиффузионного процесса с повышением концентрации раствора происходит тем значительнее, чем больше размер противоиона, тогда как константа скорости внутридиффузионного процесса не зависит от концентрации раствора. [23]
Сопоставление констант скорости процессов выщелачивания и накопления ионов магния в образцах показывает, что начальная скорость накопления ионов магния в среднем на 30 - 50 % больше, чем выщелачивание ионов кальция, а коэффициент торможения скорости реакции во времени приблизительно во столько же раз меньше. Таким образом, накопление соединений магния в образцах в основном периоде опережало эквивалентное выщелачивание ионов кальция, что обусловлено связыванием магния в гидратные новообразования. [25]
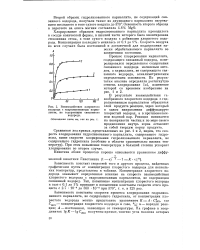 |
Взаимодействие хлористого. [26] |
Зависимость константы скорости процесса хлорирования гидролизованного карналлита, не содержащего гидроксила, от концентрации хлористого водорода можно представить уравнением К - А Снсь где СНС1 - концентрация хлористого водорода в газе, / 0; п - порядок реакции; А - постоянная, зависящая от температуры. [27]
Следовательно, константа скорости процессов подсчитывается по уравнению ( 110-а), в которое вместо концентрации следует подставить количество вещества. [28]
В - константа скорости процесса; U - энергия активации; R - постоянная Больцмана; Т - температура. [29]
К - константа скорости процесса, вычисленная на единицу внешней ( контурной) поверхности адсорбента ( величина постоянная для данной системы адсорбент-адсорбат и гидродинамической обстановки контактирования); V - объем жидкости. [30]
Страницы: 1 2 3 4