Константа - скорость - прямая
Cтраница 3
Следует подчеркнуть, что константа скорости прямой реакций первой стадии k намного меньше, чем обратной k - и чем k2, и катион тут же расходуется по мере его образования. Реакция называется мономолекулярной потому, что кинетика ее определяется первой медленной мономолекулярной стадией. [31]
Константа равновесия равна отношению констант скоростей прямой и обратной реакций. Следовательно, катализатор в одинаковое число раз ускоряет как прямую, так и обратную реакцию. [32]
В обратимой реакции АВ константы скорости прямой и обратной реакций равны 300 с-1 и 100 с-1. В исходном состоянии система содержит вещество А. За какое время концентрация А уменьшится в 2 раза. [33]
Производительность реактора зависит от констант скорости прямой / Сп и обратной / С0 реакций. [34]
Это общее соотношение между константами скорости прямой и обратной реакций в состоянии равновесия, разумеется, не зависит от принятого механизма, что нетрудно показать соответствующими расчетами. [35]
Пользуясь уравнением (V.9), рассчитывают константы скорости прямой и обратной реакций. [36]
Он в одинаковой степени изменяет константы скорости прямой и обратной реакций и только ускоряет наступление равновесия. [37]
Пр п / Собр - константы скорости прямой и обратной реакций. [38]
Так как с повышением температуры константы скорости прямой и обратной реакций k и &2 увеличиваются в различное число раз, то в новом состоянии равновесия константа / Сравн ki / kz будет иметь другое значение. [39]
Константа равновесия представляет собой отношение констант скорости прямой и обратной реакций. В дальнейшем мы часто будем пользоваться этим важным выводом, а сейчас рассмотрим еще несколько случаев, когда это обобщение удается проверить экспериментально. [40]
В главе X анализируется связь констант скорости прямой и обратной химических реакций в термодинамически равновесных и неравновесных ( двухтемпературных) средах. Анализ относится к простым одноступенчатым реакциям и к сложным реакциям, состоящим из произвольной совокупности промежуточных ступеней со всевозможными переходами по ним. Мономолекулярный распад является частным случаем сложных реакций такого рода. [41]
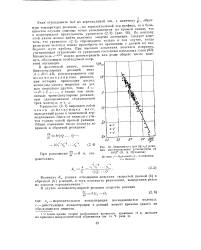 |
Зависимость lg k ( lg а21 реакции восстановления углекислоты от ЮЗ / Г ( О. А. Цуханова. [42] |
Величина Кс, равная отношению констант скоростей прямой ( k) и обратной ( k) реакций, и есть константа равновесия, выведенная ранее из законов термодинамики. [43]
Константа равновесия представляет собой отношение констант скорости прямой и обратной реакций. В дальнейшем мы часто будем пользоваться этим важным выводом, а сейчас рассмотрим еще несколько случаев, когда это обобщение удается проверить экспериментально. [44]
Величина К, равная отношению констант скоростей прямой и обратной реакций, называется константой равновесия реакции образования аммиачного комплекса меди. [45]
Страницы: 1 2 3 4