Константа - скорость - распад - гидроперекись
Cтраница 1
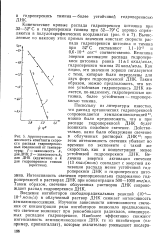
Константы скорости распада гидроперекиси циклогексила в среде циклогексана, окисляющегося в стеклянном реакторе, значительно выше, чем при распаде в эвакуированных стеклянных ампулах. Это также указывает на индуцированный распад. Тем не менее эта константа примерно вчетверо ниже, чем в случае окисления в стальном реакторе. Это различие скоростей распада гидроперекиси циклогексила позволяет понять причину высокой предельной концентрации гидроперекиси при окислении циклогексана в стеклянном сосуде. [1]
Резкое уменьшение константы скорости распада гидроперекиси при включении спирта, кетона или кислоты в координационную сферу меди может свидетельствовать об изменении конфигурации комплекса или свойств центрального атома. Вполне возможно также, что спирт ( кетон или кислота) в этом случае включается во внешнюю координационную сферу Си ( II), приводя, например, к разрушению водородных связей между молекулами гидроперекиси. [2]
Таким образом, величины констант скоростей распада гидроперекисей представляют собой эффективные константы. [3]
 |
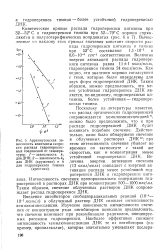
Изменение скорости инициирования цепей ( 1, отношения.| Накопление гидроперекиси циклододецила в реакции окисления циклодо. [4] |
Опыты с введением ингибитора и совпадение констант скоростей распада гидроперекиси, измеренных различными способами, указывают на нецепной распад гидроперекиси. [5]
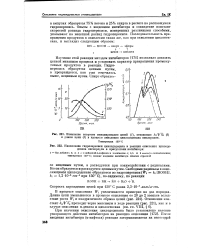
Вычисленные по наклону этих прямых значения констант скорости распада гидроперекиси цитозина и тимина при 52 С составляют 1 1 - Ю 2 и 0 6 10 - 4 сект1 соответственно. Величина энергии активации распада гидроперекиси цитозина равна 11 1 ккал / моль, гидроперекиси тимина 24 ккал / моль. Как видно, эти значения хорошо согласуются с теми, которые были определены для двух форм гидроперекисей ДНК. Таким образом, можно предположить, что менее устойчивая гидроперекись ДНК является, по-видимому, гидроперекисью цитозина, более устойчивая - гидроперекисью тимина. [7]
Вычисленные по наклону этих прямых значения констант скорости распада гидроперекиси цитозина и тимина при 52 С составляют 1 1 - 10 - 2 и 0 6 10 - 4 сект1 соответственно. Величина энергии активации распада гидроперекиси цитозина равна 11 1 ккал / моль, гидроперекиси тимина 24 ккал / моль. Как видно, эти значения хорошо согласуются с теми, которые были определены для двух форм гидроперекисей ДНК. Таким образом, можно предположить, что менее устойчивая гидроперекись ДНК является, по-видимому, гидроперекисью цитозина, более устойчивая - гидроперекисью тимина. [9]
Это находит свое отражение в выражениях для константы скорости распада гидроперекисей. [10]
Ясно, что коэффициент а может быть использован для определения константы скорости распада гидроперекиси, если известна максимальная концентрация гидроперекиси. Значения k3, вычисленные с помощью уравнения ( 12), хорошо согласуются со значениями, определенными по распаду гидроперекисей в вакууме и при окислении полипропилена. [11]
 |
Токсические свойства гликолей. [12] |
Скорость накопления гидроперекиси также растет с повышением температуры, однако при температуре выше 75 С концентрация гидроперекиси снижается, так как скорость ее разложения превышает скорость образования. Константа скорости распада гидроперекиси составляет 1 1 - 10 - 6 с 1 при 26 С, 1 6 - Ю-5 с 1 при 55 С и 9 0 - КГ5 с 1 при 75 С. Скорость окисления диэтиленгликоля возрастает с повышением парциального давления кислорода и интенсивности перемешивания. [13]
Поскольку скорость реакции окисления при повышенном давлении не увеличивается в присутствии эмульгаторов, то и увеличение скорости инициирования реакции, по-видимому, не связано с их присутствием. Было показано [42], что константа скорости распада гидроперекисей в водных растворах соды приблизительно на один порядок выше, чем в углеводороде и, следовательно, распад гидроперекиси в водной фазе создает дополнительное количество свободных радикалов при окислении в эмульсионных системах. [14]
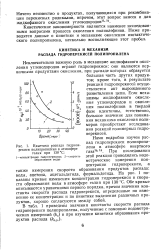 |
Кинетика распада гидроперекиси полипропилена в атмосфере гелия при 130 С. [15] |
Страницы: 1 2