Константа - скорость - реакция
Cтраница 1
Константа скорости реакции непосредственно связана с числом столкновений активных молекул. Вследствие наличия статистического равновесия между активными и инертными молекулами активные молекулы составляют какую-то определенную часть, долю от общего числа молекул. [1]
Константа скорости реакции k ( х, у) зависит как от х, так и от у. [2]
Константа скорости реакции согласно уравнению ( VIII, 159) зависит от энтропии активации AS и энтальпии активации А / /, равной энергии активации. При образовании активного комплекса в присутствии катализатора энтропия активации обычно уменьшается по сравнению с энтропией активации активного комплекса без катализатора. Это приводит к уменьшению константы скорости реакции. Таким образом, увеличение константы скорости реакции в присутствии катализатора может быть связано только с уменьшением энергии активации реакции. [3]
Константа скорости реакции зависит от природы реагирующих веществ, температуры, присутствия и концентрации катализаторов и-в растворах-от природы растворителя, являясь, таким образом, характерной величиной для сравнения скоростей различных реакций. Константы скорости реакций вычисляют из опытных данных с помощью кинетических уравнений. [4]
Константа скорости реакции О - f - N02 - NO - f - O2 равна примерно ID12 - 5 см3 / ( моль-с) при 298 К [29]; это значение почти на порядок меньше константы скорости реакции N NO. В то время как реакция N - 4 - NO достаточно быстра для исследования в струевых разрядных установках любых, даже быстрых, реакций, по отношению к реакции О N02 это верно не во всех случаях. Для низких концентраций атомов кислорода и большой линейно скорости потока метод титрования атомарного кислорода с помощью NO2 будет давать завышенные значения концентраций атомов кислорода. [5]
Константы скоростей реакций такого типа при 300 К обычно велики. [6]
Константы скорости реакции k часто определяют, измеряя тангенс угла наклона зависимости концентрация - время через различные промежутки времени и подставляя их в общее уравнение, поэтому удобнее всего пользоваться интегральной формой кинетического уравнения. [7]
Константа скорости реакции в широком интервале температур меняется по закону Аррениуса. [8]
Константа скорости реакции ki зависит от многих факторов. Изменяя один из этих факторов и сохраняя постоянными значения всех других переменных или внося поправки на их одновременное изменение, можно получить данные, характеризующие ki как функцию изменяемых параметров. [9]
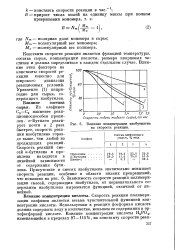 |
Влияние концентрации изобутилена на скорость реакции. [10] |
Константа скорости реакции является функцией температуры, состава сырья, концентрации кислоты, размера кварцевых частичек и должна определяться в каждом отдельном случае. Влияние этих факторов на константы скорости реакции известно для широкого диапазона реакционных условий. Уравнение ( 1) непригодно для сырья, содержащего изобутилен. [11]
Константа скорости реакции входит в решение лишь через безразмерные координаты и время, ее изменения приводят к изменению масштабов длины и времени. [12]
Константы скоростей реакций в случае N-литиевых производных циклических оснований в 10 раз превышают константу скорости реакций для литийдиэтиламида, а для литийдиалкиламидов с разветвленной цепью наблюдается дальнейшее их умень шение. [13]
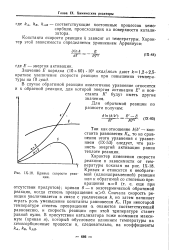 |
Кривые скорости реак - мой ( однонаправленной реакции ции - или к обратимой со степенью пре. [14] |
Константа скорости реакции k зависит от температуры. [15]
Страницы: 1 2 3 4