Константа - скорость - реакция - образование
Cтраница 1
Константа скорости реакции образования N0 сильно зависит от температуры из-за высокой энергии активации ( Та 38000 К, см. гл. Поэтому окись азота N0 образуется главным образом при максимальных пиковых температурах. В результате вычисление концентрации образовавшегося N0 с помощью средней температуры абсолютно бесполезно и необходимо учитывать флуктуации температуры. [1]
Константа скорости реакции образования водорода растет с увеличением полярности растворителя значительно быстрее константы скорости гомолиза. При пиролизе диизопропилпероксида в газовой фазе выход Н2 незначителен, что подтверждает полярность переходного состояния. [2]
Константы скорости реакции образования альдегида, окиси углерода и углекислого газа из пропилена, рассчитанные по уравнению нулевого порядка, монотонно растут с увеличением концентрации пропилена и кислорода. Следовательно, реакция протекает по более высокому порядку. При изменении концентрации пропилена и кислорода в 6 - 7 раз константы скоростей реакций, рассчитанные по уравнению первого порядка, остаются практически постоянными, что указывает на применимость этого уравнения. Расчет констант скоростей по данным Бреттона, Чен Ву-вана и Доджа [190] по окислению изобутилена на V205 согласуется с результатами окисления пропилена. [3]
Рассчитайте константу скорости реакции образования формильных производных З - нитро-4 - хлоранилина, 4-нитро - З - бром-анилина, 3 4-дихлоранилина и З - диметиламино-5 - хлоранилина при взаимодействии аминов с муравьиной кислотой в 67 % - ном пиридине при 100 С. [4]
Рассчитайте константу скорости реакции образования формильных производных З - нитро-4 - хлоранилина, З - бром-4 - нитроанилина, 3 4-дихлоранилина и 3-диметиламино - 5-хлоранилина при их взаимодействии с муравьиной кислотой в 67 % пиридине при 100 С. [5]
Таким образом, константа скорости реакции образования метиленхлорида несколько больше скорости образования хлористого метила, а константа скорости образования хлороформа составляет 0 538 контакты второй реакции. [6]
Эта величина является константой скорости реакции образования привитого полимера. [7]
Величина, полученная для константы скорости реакции образования комплекса каталаза - - Н2О2, равна приблизительно 1 - 107 л / моль-сек. Эта величина достаточно хорошо согласуется с величиной 109, которую можно ожидать для реакции в предположении, что лимитирующей стадией является диффузия. Это указывает на то, что почти каждое стол к но пение молекулы 1 ] 202 с активным центром приводит к образованию комплекса. Для реакции с разрывом связи такое значение константы, по-видимому, слишком велико. [8]
Величина, полученная для константы скорости реакции образования комплекса каталаза - Н202, равна приблизительно 1 - Ю7 л / моль сек. Эта величина достаточно хорошо согласуется с величиной 10, которую можно ожидать для реакции в предположении, что лимитирующей стадией является диффузия. Это указывает на то, что почти каждое столкновение молекулы Н202 с активным центром приводит к образованию комплекса. Для реакции с разрывом связи такое значение константы, по-видимому, слишком велико. [9]
Используя экспериментальные данные [31], были рассчитаны константы скоростей реакций образования продуктов замещения и их изомеров. [10]
Закомплексованность или функцию образования вычисляют с помощью константы скорости реакции образования комплекса. [11]
Селективность процесса окисления пропилена в акролеин определяется отношением констант скоростей реакций образования акролеина и углекислого газа. В области температур ниже 320 константа скорости реакции образования акролеина может быть больше, чем константа скорости образования углекислого газа, а в области температур выше 350, наоборот, константа скорости образования С02 больше, чем акролеина. Поэтому окисление пропилена в акролеин желательно проводить при низких температурах. Оптимальный температурный интервал проведения процесса зависит от концентрации меди на носителе. [12]
В табл. 19 и 20 приведены константы равновесия и константы скорости реакций образования и разложения различных анионных о-комплексов, а также соответствующие термодинамические и кинетические параметры. Ниже обсуждаются индивидуальные системы. [13]
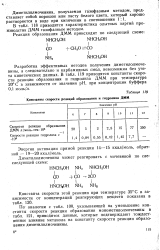 |
Константы скорости реакций образования и гидролиза ДММ. [14] |
По аналогии с табл. 100, указывающей на уменьшение константы скорости реакции образования монометилолмочевины в табл. 121, приводятся данные, которые подтверждают тождественное влияние метанола на константу скорости реакции образования диметилолмочевины. [15]
Страницы: 1 2 3 4