Константа - скорость - реакция - окисление
Cтраница 3
Реакционная способность диоксида хлора по отношению к фенолу увеличивается в следующем ряду растворителей: 2-метилпропан - 1-ол этанол 1 4-диоксан ацетон ацетонитрил этилацетат дихлор-метан гептан тетрахлорметан. Увеличение основности растворителя В приводит к уменьшению константы скорости реакции окисления фенолов диоксидом хлора: lgk - ( 0.4 0.08) - ( 7.4 0.5) - 10 3 - В. [31]
В тех случаях когда кинетика радиационной реакции подчиняется уравнению вида WKf ( c) [ где / ( с -) - функция, зависящая только от концентрации реагирующих веществ ], зависимость - скорости радиационных реакций от температуры сле-дуег уравнению Аррениуса. На рис. 20 приведены графики зависимости логарифма константы скорости реакции окисления азота под действием медленных электронов от температуры. Прямые, обозначенные цифрами, относятся к различным сериям опытов. Как видно на графике, аррениусовская зависимость для этих опытов выполняется. [32]
В тех случаях когда кинетика радиационной реакции подчиняется уравнению вида W / C / ( c) [ где / ( с -) - функция, зависящая только от концентрации реагирующих веществ ], зависимость скорости радиационных реакций от температуры следует уравнению Аррениуса. На рис. 20 приведены графики зависимости логарифма константы скорости реакции окисления азота под действием медленных электронов от температуры. Прямые, обозначенные цифрами, относятся к различным сериям опытов. Как видно на графике, аррениусовская зависимость для этих опытов выполняется. [33]
Рассчитанные по уравнению (1.2) значения констант скоростей реак-цли показали, что для всех изученных оксидных катализаторов зависимость константы скорости реакции окисления паров изопропилбензола от температуры подчиняется уравнению Аррениуса аналогично процессу окисления на платиносодержащих катализаторах. В качестве примера на рис. 1.3 представлена зависимость константы скорости реакции окисления паров изопропилбензола от температуры в координатах линейной анаморфозы Ink f ( l / T) для двух из исследованных оксидных катализаторов. [34]
Рассчитанные по уравнению (1.2) значения констант скоростей реакции показали, что для всех изученных оксидных катализаторов зависимость константы скорости реакции окисления паров изопропилбензола от температуры подчиняется уравнению Аррениуса аналогично процессу окисления на платиносодержащих катализаторах. В качестве примера на рис. 1.3 представлена зависимость константы скорости реакции окисления паров изопропилбензола от температуры в координатах линейной анаморфозы Ink f ( l / T) для двух из исследованных оксидных катализаторов. [35]
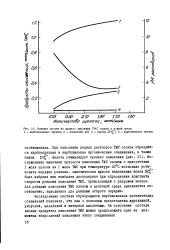 |
Влияние щелочи на процесс окисления ТМС озоном в водной среде. [36] |
Кинетическая кривая накопления ионов 0 - была избрана как наиболее достоверная при определении константы скорости реакции окисления ТМС, происходящей с разрывом кольца. Для реакции окисления ТМС озоном в щелочной среде выполняется соотношение, выведенное для реакции второго порядка. [37]
 |
Рисунков 2. Библиографических ссылок 7. [38] |
В результате экспериментов при различных напряженностях катализатора ( пла-тино-родиевого, сетчатого) и различных содержаниях аммиака в аммиачно-воздушной смеси установлен первый порядок реакций по аммиаку, нулевой - по кислороду и общий порядок реакции - первый. Найдена величина кажущейся энергии активации Е 25 85 кдок / моль ( 6175 кал / моль), приведено уравнение для определения константы скорости реакции окисления аммиака на сетчатом платиновом катализаторе. [39]
Уменьшение поверхности за счет адсорбции окиси углерода отвечает первому порядку при константе скорости, равной 0 0027 мин-1. При восстановлении поверхности двуокиси марганца приблизительно на 5 % реакция окиси углерода с кислородом протекает по первому порядку, а константа скорости становится равной 0 0215 мин-1 - Константы скорости показывают, что скорости обмена и уменьшения поверхности приблизительно равны между собой, в то время как константа скорости реакции окисления примерно в 10 раз больше. Таким образом, из данных по кинетике и изотопного обмена можно сделать предположение, что механизм окисления на двуокиси марганца протекает путем чередования восстановления и окисления поверхности. Авторы предполагают, что при более высоких температурах соотношение между скоростями отдельных стадий и скоростью реакции может быть различным. [40]
Приведенные шесть условий могут быть выражены алгебраически через известные коэфициенты окисления NO, поглощения окиси, испарения НаО и теплопереноса, и через энтальпии веществ, участвующих в происходящих процессах. Эти условия могут быть-преобразованы в желаемые дифференциальные уравнения, которые можно проинтегрировать и получить численный результат, выразив V через h и продифференцировав. Кроме того, поскольку коэфициент поглощения газовой пленки и константа скорости реакции окисления NO убывают с повышением температуры медленно, то мы не сделаем большой ошибки, приняв, что для каждого участка температура газа и жидкости постоянна и равна средней для данного участка величине. [41]
Страницы: 1 2 3