Константа - скорость - реакция - первый порядок
Cтраница 2
Температурная зависимость константы скорости реакции первого порядка описывается уравнением Аррениуса. [16]
Для расчета констант скорости реакций первого порядка при разложении метана были использованы данные нескольких исследователей. [17]
Какова размерность константы скорости реакции первого порядка и в каких единицах измеряется константа скорости. [18]
Наряду с константой скорости реакции первого порядка характеризуют также периодом полураспада т ( греч. [19]
Более того, константа скорости реакции первого порядка / Cj равна константе скорости реакции диссоциации акво-комплекса. Например, для систем, в которые введена изотопная метка, ki должна быть равна скорости обмена молекул воды. Однако обычно они не были успешны, поскольку возникали осложнения из-за заряда реагентов и чувствительности их к окружению. [20]
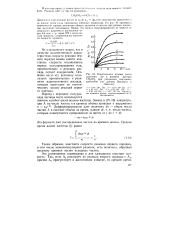 |
Кинетические кривые роста давления Др в реакции распада CH3NH2 при различных начальных давлениях ( по данным Эмелиуса и Джолли. [21] |
Таким образом, константа скорости реакции первого порядка, в том числе мономолекулярной реакции, есть величина, обратная среднему времени жизни исходных частиц. [22]
Величина km, константа скорости реакции первого порядка, при высоких давлениях может быть определена экспериментально, a kj, в соответствии с простой теорией столкновений должна быть равна Z - ie - E RlT, где Е - энергия активации. Однако в большинстве случаев при этом расчете получается, что константа скорости реакции первого порядка должна уменьшаться, начиная с более высоких давлений, чем это наблюдается в действительности. Эта трудность, как показано ниже, была преодолена Хиншельвудом. [23]
Как видно, константа скорости реакции первого порядка не зависит от способа выражения концентраций. [24]
Поэтому и величина константы скорости реакции первого порядка не зависит от выбора размерности для концентрации. [25]
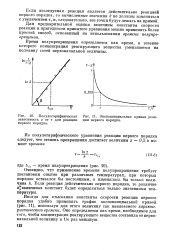 |
Полулогарифмическая зависимость ж от т для реакции первого порядка.| Экспоненциальная кривая реакции первого порядка. [26] |
Иногда для отыскания константы скорости реакции первого порядка удобно применять график экспоненциальной кривой ( рис. 11), используя для этого величину так называемого характеристического времени. Оно определяется как время, необходимое для того, чтобы концентрация реагирующего вещества составила от первоначальной величину в 1 / е раз меньшую. [27]
Величина, обратная константе скорости реакции первого порядка, имеет размерность времени и называется средней продолжительностью жизни отдельной частицы. Для характеристики скорости реакции первого порядка наряду с константой скорости часто пользуются так называемым временем полупревращения или полураспада t / %, равным промежутку времени, в течение которого реагирует половина взятого количества вещества. [28]
Величина, обратная константе скорости реакции первого порядка, представляет собой среднее время жизни отдельной молекулы. [29]
Множитель k называют константой скорости реакции первого порядка. Реакция такого рода называется реакцией первого порядка. [30]
Страницы: 1 2 3 4