Константа - скорость - данная реакция
Cтраница 3
Концентрации реагирующих веществ увеличиться от этого не могут. Следовательно, константа скорости данной реакции является действительно постоянной величиной только при заданной температуре. Как бы мы ни меняли концентрации веществ А и В, константа скорости от этого не меняется; она, следовательно, не зависит от концентраций реагирующих веществ. [31]
Тогда приходится оценивать это с помощью приближенных методов. Очевидно, для оценки константы скорости данной реакции только из теории необходимо определить как Еа, так и А. Для точного теоретического вычисления Еа нужно знать форму поверхностей потенциальной энергии реагентов и переходного состояния. Подобный расчет практически невозможно сделать для обычных активированных комплексов из четырех атомов или более и в большинстве случаев приходится отказываться от вычисления Еа из теоретических поверхностей потенциальной энергии. Для оценки Еа в отдельных реакциях были предложены приближенные методы, но в целом достигнут небольшой прогресс в этой области. Напротив, теоретическое вычисление множителя А не требует точного знания поверхностей потенциальной энергии для реакций и существуют некоторые удобные методы оценки величин А для отдельных реакций. Некоторые из этих методов и будут рассмотрены ниже. [32]
Эта замена позволяет использовать указанное уравнение для расчеаа необходимого объема реактора для осуществления заданной степени превращения. Очевидно, что для такого расчета необходимо заранее определить константы скоростей данной реакции. [33]
Если температура поддерживается постоянной, то для разных значений г и ( а-х) вычисленные величины констант К будут близкими. По 6 - 7 наилучшим результатам находят среднее значение константы скорости данной реакции при данной температуре. [34]
Если температура поддерживается постоянной, то для разных значений т и а - х вычисленные величины констант k будут близкими. По 6 - 7 наилучшим результатам находят среднее значение константы скорости данной реакции при данной температуре. [35]
Если желают получить поликонденсат с большим молекулярным весом, то, в соответствии с законом действия масс, реакцию ведут, удаляя побочные продукты. Так, при поликонденсации, в процессе которой происходит выделение летучих побочных продуктов, например Н2О, НС1, NH3, последнюю стадию реакции проводят при пониженном давлении. Это правило не всегда обязательно соблюдать, например конденсация фенола с формальдегидом идет достаточно далеко, даже если не удалять воду из реакционной среды, но это возможно только благодаря большому значению константы скорости данной реакции. При удалении воды или других летучих побочных продуктов поликонденсации необходимо помнить, что во время их отсасывания в вакууме чполиконденсация продолжается и скорость ее зависит от температуры реакции. Поэтому следует применять возможно меньшее остаточное давление, но все же не слишком низкое, чтобы не было потерь реагентов. Обезвоживание литой фенольной смолы при слишком высоком давлении и поэтому при слишком высокой температуре может привести к преждевременному затвердеванию смолы в сосуде, в котором проводят ее обезвоживание. [36]
Если желают получить поликонденсат с большим молекулярным весом, то, в соответствии с законом действия масс, реакцию ведут, удаляя побочные продукты. Так, пришоликонденсации, в процессе которой происходит выделение летучих побочных, продуктов, например HgQ, JHC1, NH3, последнюю стадию реакции проводят при понижением давлении. Это правило не всегда обязательно соблюдать, например конденсация фенола с формальдегидом идет достаточно далеко, даже если не удалять воду из1 реакционной; среды, но это возможно только благодаря бояЕШОЩу значению константы скорости данной реакции. [37]
Константа скорости реакции зависит от природы реагирующих веществ и от условий проведения реакции, например от температуры. Таким образом, когда концентрации реагирующих веществ равны по 1 моль / л, то константа скорости численно равна скорости реакции. Отсюда следует, что константа скорости данной реакции является постоянной величиной лишь при данной температуре. [38]
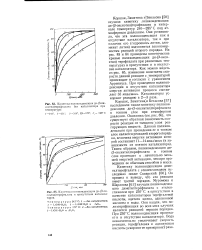 |
Кинетика поликонденсации ди - ( р-ок-сиэтил терефталата без катализатора при температуре.| Кинетика поликонденсации ди - ( [ 3-ок-сиэтил терефталата в присутствии катализаторов. [39] |
Коршак, Замятина и Бекасова [58] изучили кинетику лоликонденсации ди - ( р-оксиэтил) терефталата в интервале температур 240 - 285 С под атмосферным давлением. Они установили, что эта пол и конденсация как в отсутствие катализатора, так и при наличии его ( гидроокись лития, алюминат лития) подчиняется закономерностям реакций второго порядка. На рис. 83 и 84 приведены кинетические кривые поли конденсации ди - ( ( 3-окси-этил) терефталата при различных температурах в присутствии и в отсутствие катализатора. Как можно видеть из рис. 85, изменение константы скорости данной реакции с ьтемпературой происходит в согласии с уравнением Аррениуса. При проведении поликонденсации в отсутствие катализатора энергия активации процесса составляет 35 ккал / молъ. Катализаторы ускоряют реакцию в 2 - 3 раза. [40]
Эти результаты показывают, что скорость реакции в газе и в растворе - величины одного порядка. Однако величина для л-гексана оказывается примерно в 108 раз меньше, чем константа, вычисленная по уравнению Ze-EIBT, причем Е равно 146СО кал. То же самое должно иметь место и при реакции между газообразными компонентами. Как известно, образование таких четвертичных аммониевых солей было изучено Меншуткиным ( 1890 г.) в ряде растворителей. Наивысшая скорость была замечена в растворе в бензиловом спирте. Однако, поскольку эта скорость превышает скорость в л-гексане меньше, чем в 800 раз, все же остается необъяснимым фактор Р порядка Ю-5. Нужно заметить, что в этом случае константа скорости реакции больше чем в газовой фазе, так что бензиловый спирт и другие растворители, например ацетон и этиловый спирт, оказывают положительное каталитическое действие. Растворители, вроде четыреххлористого углерода или л-гексана, были названы нормальными, так как все они дают мало отличающиеся от газовой фазы константы скорости данной реакции. [41]
Страницы: 1 2 3