Константа - скорость - рекомбинация
Cтраница 4
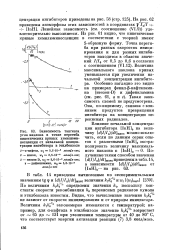 |
Зависимость тангенса угла наклона в точке перегиба кинетических кривых хемилюминесценции от начальной концентрации ингибитора в этилбензоле. [46] |
По величинам k 1 2 определены значения / с7, поскольку константы скорости рекомбинации ke перекисных радикалов кумола и этилбензола известны. Видно, что вычисленные значения k 1 не зависят от скорости инициирования и от природы инициатора. Величины &7 & б / 2 закономерно изменяются с температурой; например, для а-нафтола в этилбензоле значение k7k возрастает от - 65 до - 131 при увеличении температуры от 40 до 80 С, что соответствует энергии активации реакции ( 7) 3 8 ккал / молъ. [47]
Отрицательную роль в блокировании обратных процессов играет то обстоятельство, что константа скорости рекомбинации атомов фтора: F F М р2 М на три порядка меньше скорости рекомбинации других атомов. В результате процесса присоединения атома фтора: UFs F М UF6 М, эффект радиационно-химической диссоциации нивелируется. [48]
Расчеты Кимбалла удовлетворительно согласуются с данными, полученными на основе экспериментальных значений констант скорости рекомбинации, только для квазимолекул с небольшим числом атомов. [49]
Мы видим, что образование комплекса J3 может привести к правильному значению констант скоростей рекомбинации и диссоциации, находящихся в соответствии с величиной константы равновесия. [50]
Как видно из табл. 4, в случае различных М температурная зависимость константы скорости рекомбинации данной пары частиц различна. [51]
Скорость рекомбинации радикалов равна 2 / с8 [ R12, где ks - константа скорости рекомбинации, л / молъ сек; [ R ] - молярная концентрация радикалов R. Скорость реакции ( 9) равна k9 [ R ] [ S ], где &9 - константа скорости реакции ( 9); [ S ] - молярная концентрация S. Радикалы R образуются со скоростью, пропорциональной мощности дозы. Она, очевидно, равна GR ( 7 / 100 дг), где GR - выход радикалов; / - мощность поглощенной дозы, зв / л-сек; JV - число Авогадро. Скорости образования и исчезновения радикалов должны быть равны. [52]
Из табл. 13 также следует, что в случае различных М температурная зависимость константы скорости рекомбинации данной пары частиц различна. Следовательно, соотношение эффективностей различных М, установленное для одной температуры, вообще говоря, будет другим при другой температуре. [53]
Таким образом, метод кислородного последействия позволяет определить из одного опыта не только константу скорости рекомбинации перекисных радикалов ke ( процесса, сопровождаемого свечением), но и радикалов R, при рекомбинаций которых свечение практически отсутствует. [54]
Очевидно, что такой механизм реакции через промежуточный комплекс может быть привлечен для непосредственного расчета константы скорости рекомбинации А и В. [55]
Только в случае &4 ke ( см. рис. 100) метод кислородного последействия неприменим для определения констант скорости рекомбинации. [56]
Из рассмотрения соотношения между скоростями полимеризации и образования первичных радикалов авторы делают вывод о том, что константа скорости рекомбинации растущих радикалов с первичными радикалами много больше, чем эта константа для двух растущих радикалов. Отношение [ S ] / [ Af ] ( концентраций радикалов растворителя и концентраций растущих радикалов) пропорционально ( 1 / Х -) п; X - объемная доля мономера, п - постоянная величина. [57]
Страницы: 1 2 3 4