Константа - тушение
Cтраница 2
Если флуоресцирующие вещества, связанные с молекулами полимера, образуют нефлуоресцирующий комплекс, интенсивность флуоресценции, естественно, должна уменьшаться с увеличением концентрации полимера. Снижение флуоресценции должно подчиняться уравнению Штерна - Фольмера, причем константа тушения соответствует константе равновесия образования комплекса. [17]
Это уравнение Штерна и Фольмера, которое авторы широко применяли для анализа разовых систем, а Вавилов [49] - при исследовании растворов. Отношение ( Iй - I) i I0 Q названо константой тушения. Эффективность тушения флуоресценции убывает в ряду анионов I NCS - Br - СГ NOJ F -, который совпадает с рядом по уменьшению поляризуемости [19] и коагулирующей способности, а также с рядом по возрастанию сродства к электрону. Отклонения от линейности, определяемой уравнением (5.20), обсуждались в работах [4,52], в частности, применительно к тушению атом. Эти отклонения, по крайней мере отчасти, обусловлены первичным электролитическим эффектом, который мы рассмотрим в гл. [18]
Сенсибилизаторы подбирают так, чтобы одновременно наблюдалось как тушение флуоресценции донора, так и появление флуоресценции акцептора - диацетила. Это дает возможность независимо измерить константу сенсибилизации свечения акцептора Ks и константу тушения флуоресценции донора Kg, а затем сравнить эти величины. [19]
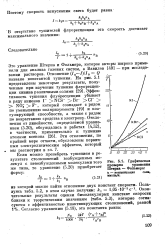 |
Графическая проверка уравнения Штерна - Фольмера. [20] |
Это уравнение Штерна и Фольмера, которое авторы широко применяли для анализа газовых систем, а Вавилов [49] - при исследовании растворов. Отношение ( / - /) / / 0 Q названо константой тушения. Эффективность тушения флуо ресценции убывает в ряду анионов I NCS - Br - СГ NOg F -, который совпадает с рядом по уменьшению поляризуемости [19] и коагулирующей способности, а также с рядом по возрастанию сродства к электрону. Эти отклонения, по крайней мере отчасти, обусловлены первичным электролитическим эффектом, который мы рассмотрим в гл. [21]
Таким образом, тушение также следует уравнению Штерна - Фольмера, но константа тушения представляет собой константу равновесия образования комплекса. [22]
В действительности с помощью фотоэлектрической спектрофотометрической установки были проведены детальные измерения зависимости хода тушения от давления кислорода и для каждого соединения, испытывающего тушение, получены количественные данные о величине константы тушения. В пятой графе приводятся значения длительности возбужденного состояния молекул, полученные из констант тушения паров в предположении, что выход тушащего столкновения равен единице. Справедливость этого предположения была проверена непосредственными измерениями т на флуорометре ФИАНа для спиртового раствора антранола, которые дали для т значение, практически совпадающее с полученным из константы тушения. [23]
Как уже отмечалось, обменные взаимодействия могут играть существенную роль в протекании еще одного типа процессов - тушении позитрония парамагнитными комплексами по механизму орто-пара-конвер-сии. К сожалению, в настоящее время мы не располагаем данными для количественного сопоставления констант тушения со спиновыми плотностями на периферии комплекса. Специально проведенные с этой целью исследования [32] показали, однако, что введение иона С1 - в координационную сферу Со ( II) в водно-спиртовых смесях приводит к значительному увеличению - константы скорости тушения. Интересно отметить, что в ца-раллельно поставленных опытах по спиновому обмену Со ( II) с ТМОПО, БДХ и ДФПГ в тех же условиях влияние иона хлора оказалось аналогичным. [24]
Таким образом, если измеряется флуоресценция нескольких растворов, отличающихся концентрацией тушителя, и отсчет на шкале прибора R пропорционален интенсивности флуоресценции, то зависимость величины ( R / R-1) от концентрации тушителя представляет собой прямую линию с наклоном, равным К. Соотношения ( 73) и ( 75) впервые использовали Штерн и Фольмер [75], и величину К обычно называют константой тушения Штерна - Фольмера. [25]
Следовательно, время жизни молекулы в возбужденном состоянии т, найденное из уравнения ( V-3), составляет величину порядка 10 - 9 сек. Если для другого тушителя константа тушения Штерна - Фольмера меньше, чем для KI, то легко видеть, что не каждое столкновение приведет к тушению. Если константа тушения Штерна - Фольмера берется для флуоресцирующего вещества с тем же временем жизни в возбужденном состоянии и она много больше, чем для К1, то формально этот процесс может быть описан как дальнодействующее взаимодействие ( см. гл. IV, ссылка [12]), эквивалентное большому радиусу столкновения. Однако чаще всего высокие значения констант обусловлены образованием комплексов между тушителем и флуоресцирующей молекулой, неспособных к флуоресценции. Можно ожидать, что спектр поглощения такого комплекса отличается от соответствующего спектра исходной флуоресцирующей молекулы. [26]
Методика состоит в определении относительной интенсивности флуоресценции либо в глицерине при различных температурах ( рис. 106), либо в другой вязкой низкомолекулярной жидкости при одной температуре; во всех случаях вязкость среды определяется обычными методами. Если построить график зависимости величины обратной интенсивности флуоресценции от Т 1ц, то наклон полученной прямой дает величину Ь, а отсекаемый отрезок - / о. Для исследования процессов тушения достаточно знать константы тушения Штерна - Фольмера. [27]
В действительности с помощью фотоэлектрической спектрофотометрической установки были проведены детальные измерения зависимости хода тушения от давления кислорода и для каждого соединения, испытывающего тушение, получены количественные данные о величине константы тушения. В пятой графе приводятся значения длительности возбужденного состояния молекул, полученные из констант тушения паров в предположении, что выход тушащего столкновения равен единице. Справедливость этого предположения была проверена непосредственными измерениями т на флуорометре ФИАНа для спиртового раствора антранола, которые дали для т значение, практически совпадающее с полученным из константы тушения. [28]
Недавно были сделаны попытки определить механизм межмолекулярного тушения триплетов ионами металлов. Портер и Райт [190, 196] отмечают, что диамагнитные ионы, такие, как Zn2 и Ga3, не оказывают заметного тушащего влияния на триплетные состояния нафталина в воде. С другой стороны, определенные парамагнитные ионы типа Ni2 и Fe2 обладают значительным межмолекулярным каталитическим тушащим действием на. Иногда это влияние рассматривалось как обусловленное возмущающим действием их неоднородного магнитного поля. Аналогичные представления были развиты для объяснения тушения парамагнитными молекулами кислорода и окиси азота. Однако из последних экспериментальных исследований, в том числе тех, где за концентрацией триплетов следили непосредственно с помощью скоростной абсорбционной спектроскопии [196], выяснилось, что в случае нехелатированных ионов не существует прямой связи между константой тушения триплетов органических соединений ионами металлов и их магнитными моментами. Подобным образом сильное тушащее действие кислорода, очевидно, не обусловлено непосредственно его парамагнитными свойствами. Такие же заключения были сделаны и другими исследователями [192, 193, 166], которые изучали сходные явления возмущающего действия добавок на интенсивность синглет-триплетного поглощения. [29]
Страницы: 1 2