Бимолекулярная константа - скорость - реакция
Cтраница 1
Бимолекулярные константы скорости реакций e q примерно на порядок меньше констант скорости реакций ионов На, которые, как показали Эйген и др. [38], зачастую лежат в пределах от 1011 до 1012 см. / сек и для которых предполагается наличие туннельного эффекта в среде с водородными связями. Вместо этого более естественно считать, что электрон связан с группой молекул воды, многие из которых могут двигаться с ним во время его диффузионных перемещений. [1]
ЕЦ - бимолекулярная константа скорости реакции ФОС с ХЭ; В - постоянная интегрирования. [2]
Установлено, что экспериментально определяемая бимолекулярная константа скорости реакции всех трех ФОС с обеими хо-линэстеразами зависит от концентрации тетраалкиламмонийного иона. При малых концентрациях четвертичного иона зависимость близка к линейной; при некоторой концентрации иона кривая начинает асимптотически приближаться к оси абсцисс. [3]
Часто наблюдают уменьшение бимолекулярной константы скорости реакции ароматического нуклеофильного замещения по мере того, как начальная концентрация одного из реагирующих веществ возрастает. [4]
 |
Бимолекулярные константы скоростей для реакций е - с различными органическими соединениями. ( Литературные источники слишком многочисленны, чтобы на них можно было сослаться. [5] |
К настоящему времени определено огромное число бимолекулярных констант скорости реакций, в которых одним из реагентов является электрон. Надежно обобщить факторы, влияющие на скорости этих реакций, все еще невозможно. Однако приведенные ниже замечания могут служить указаниями для будущих обобщений. [6]
 |
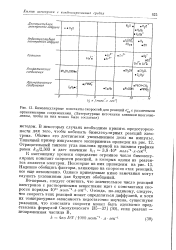
Влияние начальной. концентрации электролита на сте-хиометрическую константу скорости второго порядка реакции CH3I C2H5ONa - - CH3OC2HS Nal в этанольном растворе при 24 С. [7] |
На рис. 8.1 показано, как меняется в зависимости от концентрации бимолекулярная константа скорости реакции между йодистым-метилом и алкоголятом натрия, взятыми в эквимолярных концентрациях при 24 С в этаноле. На рис. 8.1 оригинальные данные работы [23] представлены в пересчете на -, употребляемые в настоящее время единицы, отличные от несколько необычных единиц концентрации, использованных авторами. Из рис. 8.1 видно, что константа скорости снижается по мере повышения концентрации. Этот эффект обнаружен и во многих других системах, в которых одним из реагентов является электролит. Константы скорости при любой данной температуре хорошо воспроизводятся эмпирическими соотношениями, которые хотя и применялись в последующих работах [9, 19], не имеют определенного физического смысла. [8]
По вероятностям p0i можно убедиться в том, что если бы бимолекулярные константы скорости реакций с участием аммиака были пропорциональны этим вероятностям, то последние давали бы в величину RTa ( din kzJdT) p вклад, составляющий от - 6 до - 25 ккал / моль. Наименьшего из этих значений было бы достаточно для объяснения кажущейся медленности многих реакций между аминами и галоген-производными в неполярных растворителях. Следует подчеркнуть, что существенной является не сама величина р91, а ее зависимость от температуры. [9]
 |
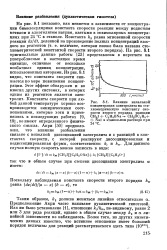
Влияние начальной. концентрации электролита на сте-хиометрическую константу скорости второго порядка реакции CH3I C2H5ONa - СН3ОСаН5 Nal в этанольном растворе npir 24 С. [10] |
На рис. 8.1 показано, как меняется в зависимости от концентрации бимолекулярная константа скорости реакции между йодистым метилом и алкоголятом натрия, взятыми в эквимолярных концентрациях при 24 С в этаноле. На рис. 8.1 оригинальные данные работы [23] представлены в пересчете на-употребляемые в настоящее время единицы, отличные от несколько необычных единиц концентрации, использованных авторами. Из рис. 8.1 видно, что константа скорости снижается по мере повышения концентрации. Этот эффект обнаружен и во многих других системах, в которых одним из реагентов является электролит. Константы скорости при любой данной температуре хорошо воспроизводятся эмпирическими соотношениями, которые хотя и применялись в последующих работах [9, 19], не имеют определенного физического смысла. [11]
Для расчета AS может быть использовано уравнение (IX.7) при условии экспериментального определения энергии активации и бимолекулярной константы скорости реакции фермента с необратимым ингибитором. [12]
Таким образом, согласно этому уравнению, если верно предположение, что в присутствии обратимого ингибитора необратимый ингибитор не реагирует с какими-либо группировками активного центра, то между обратной величиной бимолекулярной константы скорости реакции фермента с необратимым ингибитором и концентрацией обратимого ингибитора должна быть линейная зависимость. [13]
Из этих уравнений с использованием измеренных констант скорости следует, что электрон ведет себя так, как если бы он представлял собой сферический анион с радиусом - - 3 А и коэффициентом диффузии приблизительно 2 - 10 - 6 см2 - сек-г. Бимолекулярные константы скорости реакций e q примерно на порядок меньше констант скорости реакций ионов Hog, которые, как показали Эйген и др. [38], зачастую лежат в пределах от 1011 до 1012 смя / сек и для которых предполагается наличие туннельного эффекта в среде с водородными связями. Вместо этого более естественно считать, что электрон связан с группой молекул воды, многие из которых могут двигаться с ним во время его диффузионных перемещений. [14]
Выше было приведено уравнение для вычисления бимолекулярной константы скорости необратимой реакции фермента с ингибитором. В соответствии с этим уравнением бимолекулярная константа скорости реакции может быть вычислена, если известны начальные молярные концентрации фермента и ингибитора и убыль концентрации одного из реагирующих компонентов ( обозначим ее xt) во времени. [15]
Страницы: 1 2