Соответствующая константа - скорость
Cтраница 3
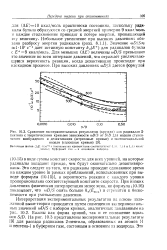
Джэк [172] определил константы скоростей при 25 для системы N205, содержащей избыток N0 С02, которые примерно в 3 раза меньше, чем соответствующие константы скоростей, найденные Милсом и Джонстоном и примененные в указанных выше вычислениях. Кассель показал, что данные Милса и Джонстона для скоростей при высоких давлениях, вероятно, были ошибочными. [31]
В изученной серии установлено наличие компенсационного эффекта, что подтверждается изокинетическим соотношением lg А 4200 / / lg & 215, согласно которому между соответствующими константами скоростей процесса гомополиконденсации смешанных р-аминоэтилалкиловых ( фенилового) эфиров метилфосфоновой кислоты, измеренных при двух различных температурах ( например, 200 и 215 С), существует линейная зависимость. [32]
Джэк [172] определил константы скоростей при 25 для системы N205, содержащей избыток N0 - - С02, которые примерно в 3 раза меньше, чем соответствующие константы скоростей, найденные Милсом и Джонстоном и примененные в указанных выше вычислениях. Кассель показал, что данные Милса и Джонстона для скоростей при высоких давлениях, вероятно, были ошибочными. [33]
Кута [56] показал, что в полном соответствии с уравнением ( 69) зависимость предельного кинетического тока от концентрации борной кислоты является нелинейной, и вычислил соответствующие константы скорости диссоциации и рекомбинации. [34]
KCO - скорость окисления нафталина во фталевый ангидрид, малеиновый ангидрид, 1 4-нафтохинон и двуокись углерода; kv kt, ka, kt, - соответствующие константы скорости окисления; Снафт - текущая концентрация нафталина. [35]
Если в распоряжении экспериментатора имеются макроскопические количества препарата чистого изотопа и реакция проводится с каждой изотопной формой в отдельности, то после выяснения кинетики реакции измерение соответствующих констант скоростей, а следовательно, и изотопного эффекта является в принципе простой задачей. Однако во многих случаях весьма трудно или даже невозможно приготовить вещества, содержащие только один изотоп. В таких случаях часто нерационально тратить усилия на получение вещества с очень высокой изотопной чистотой, так как при содержании лишь индикаторных количеств одного из изотопов удается получать ценные результаты. Более того, в случае радиоактивных изотопов даже нежелательно работать с чрезмерно высокими удельными активностями. Следует подбирать такую удельную активность, которая удобна при данном применяемом методе изотопного анализа. Обычно бывает достаточно сравнительно низких удельных активностей, не требующих слишком больших предосторожностей для защиты от радиации. [36]
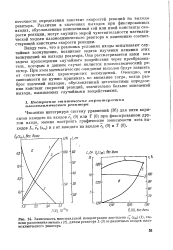 |
Зависимость максимальной концентрации ацетилена с3 ( zm ( 1, степени разложения метана s ( 2, длины реактора L ( 3 от различных входов плазмохимического реактора. [37] |
Различия в значениях выходов при фиксированных входах, обусловленные изменениями той или иной константы скорости реакции, могут служить мерой чувствительности математической модели плазмохимического реактора к изменению соответствующей константы скорости реакции. [38]
Однако применимость метода стационарного состояния ко многим случаям полимеризации виниловых соединений в гомогенной фазе впервые была установлена не этим путем, так как объяснение механизма этих реакций и определение соответствующих констант скоростей требует априори использования метода стационарного состояния. Эта гипотеза использовалась также и потому, что, как показывают экспериментальные данные, изменение скорости реакции во времени часто является величиной того же порядка, что и изменение концентрации реагентов. [39]
Здесь следует отметить, что Н. Н. Семенов [57], рассматривая предложенную Льюисом и Эльбе реакцию вырожденного разветвления, отметил, что так как она представляет собой реакцию свободного радикала с молекулой и соответствующая константа скорости несомненно велика, то характеристическое время всего процесса окисления углеводорода должно быть очень малым, таким же, как в обычных разветвленных процессах. А это означает, что в случае разветвления путем реакции свободного радикала с молекулой весь процесс окисления углеводорода не должен иметь вырожденно-разветвленного характера. ROZ R GHO отлична от обычной реакции разветвления ( например, Н 02 - ОН О) в том отношении, что концентрация промежуточного продукта R CHO в начальный момент процесса окисления углеводорода равна нулю и на значительной по времени начальной стадии процесса несоизмерима с концентрацией исходных веществ. Поэтому, пока концентрация промежуточного продукта R GHO еще только нарастает от нуля до небольших измеримых количеств, скорость разветвления, а следовательно, и всего процесса будет ничтожно мала, то есть практически окисление углеводорода будет протекать как неразветвленный процесс. [40]
При изменении внешних параметров, таких, как температура, давление или напряженность электрического поля, мгновенно изменяются константы скоростей реакций, а за ними концентрации отдельных компонентов в соответствии с величинами соответствующих констант скоростей и концентраций. Если какая-либо химическая реакция не зависит от этих внешних параметров, она может быть сопряжена сдругой реакцией, которая имеет высокую чувствительность к одному из этих параметров и протекает значительно быстрее, чем реащия, не зависящая от указанных параметров. В этом случае можно считать, что химическая релаксация реакций, не зависящих от внешних параметров, инициируется концентрационным скачком, возникающим в результате протекания химической реакции, реагирующей на изменения внешних параметров. [41]
Это следует из того, что радикалы проводят одинаковое время на каждом уровне [ в рамках приближений, использованных при выводе формулы (10.15) ], а вероятность реакции с каждого уровня пропорциональна соответствующей константе скорости. S опять больше ka ( Emax) и стремится к бесконечности при уменьшении давления. [43]
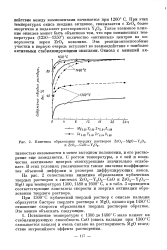 |
Кинетика образования твердых растворов ZrO2 - MgO - Y20. [44] |
На рис. 2 сопоставлена кинетика образования кубических твердых растворов в системах Zr02 - Y203 - CaO и Zr02 - Y203 - MgO при температурах 1300, 1480 и 1600 С, а в табл. 3 приведены соответствующие константы скорости и энергия активации образования твердого раствора. [45]
Страницы: 1 2 3 4