Эффективная константа - скорость - реакция
Cтраница 4
В предположении, что реакция идет только в прямом направлении, по полученным результатам с помощью уравнений Бассета и Хэбгуда 8 ] были вычислены эффективные константы скорости реакции первого порядка. [46]
Модель процесса сульфирования сополимеров с предварительным набуханием в тионилхлориде и соответствующий моделирующий алгоритм ( см. рис. 5.11, 5.12) использовались при решении обратной задачи для поиска эффективной константы скорости реакции сульфирования К, и эффективного коэффициента массо-проводимости D. Время прямого счета по уравнениям модели составило 4 мин; время поиска коэффициентов Ks и D по минимуму отклонений расчетных и экспериментальных значений конверсии ( алгоритм поиска с применением чисел Фибоначчи) составило 30 мин. [48]
В зависимости от соотношения фенола к ацетону в наших опытах ( см. табл. 2) наблюдаются изменения величины как предэкспонентного множителя, так и энергии активации в наблюдаемой эффективной константе скорости реакции. При этом одновременно с увеличением энергии активации увеличивается и величина предэкспонентного множителя, компенсируя уменьшение константы скорости, вызванное ростом энергии активации. [49]
 |
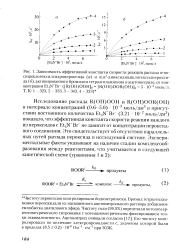
Зависимость эффективной константы скорости реакции H2OS с Fe3 при 25 С от ионной силы раствора. Сплошная линия проведена по ( поданным В. М. Берд-никова и О. С. Журавлевой. [50] |
Поскольку на остальных стадиях процесса, описываемого схемой (111.92), изменения заряда частиц не происходит, то такую же зависимость от ионной силы будет иметь и скорость реакции в целом, а Следовательно, и эффективная константа скорости реакции. [51]
Изменение соотношения констант скоростей приводит к существенным изменениям кинетики реакции при том же механизме: увеличивается порядок реакции по веществу В с нулевого до первого, перестает соблюдаться условие стационарности для промежуточного вещества X, уменьшается в семь раз эффективная константа скорости реакции. Расчеты по начальным скоростям ( рис. 136, б) дают первый порядок по обоим реагентам, хотя из рис. 136, б видно, что после начального момента порядки реакции по веществам А и В различаются. [52]
Исследование распада R ( OH) OOH и R ( OH) OOR ( OH) в интервале концентраций ( 0.6 - 5.0) - 10 - 3 моль / дм3 в присутствии постоянного количества Et4lSrBr - ( 3.21 10 2 моль / дм3) показало, что эффективная константа скорости реакции каждого из пероксидов с Et4N Br не зависит от концентрации пероксид-ного соединения. Это свидетельствует об отсутствии параллельных путей распада пероксида в исследуемой системе. [54]
Исследование распада R ( OH) OOH и R ( OH) OOR ( OH) в интервале концентраций ( 0.6 - 5.0) - 10 3 моль / дм3 в присутствии постоянного количества Et4N Br - ( 3.21 10 - 2 моль / дм3) показало, что эффективная константа скорости реакции каждого из пероксидов с Et4N Br - не зависит от концентрации пероксид-ного соединения. Это свидетельствует об отсутствии параллельных путей распада пероксида в исследуемой системе. [56]
Исследование распада R ( OH) OOH и R ( OH) OOR ( OH) в интервале концентраций ( 0.6 - 5.0) 10 - 3 моль / дм3 в присутствии постоянного количества Et4N Br - ( 3.21 - 10 - 2 моль / дм3) показало, что эффективная константа скорости реакции каждого из пероксидов с Et4N Br - не зависит от концентрации пероксид-ного соединения. Это свидетельствует об отсутствии параллельных путей распада пероксида в исследуемой системе. [58]
На основании анализа данных о чувствительности эффективных констант скорости реакций к изменению условий испытания, природы и соотношения компонентов, добавок монофункциональных спиртов, температуры реакции и характера реакционной среды при проведении процесса в модельных условиях путем варьирования концентрации специальных добавок был сделан вывод о том, что за наблюдаемые изменения эффективных констант скоростей реакций на различных стадиях процесса ответственны общие особенности механизма реакции образования полиуретанов. К числу последних относятся: различная реакционная способность функциональных групп в исходных мономерах, эффекты замещения в ходе реакции, ассоциация функциональных групп за счет донорно-акцепторного взаимодействия и другие факторы. [59]
С - секундомер; t - время реакции; 1IT - поляриметрическая трубка ( заполняют раствором до краев) Ф - фильтровальная бумага; П - поляриметр; at угон Т - термостат водяной с температурой 80 С; а0 - начальный вращения; ах - предельный угол вращения; С ( 1 начальная концентрация сахара; С - концентрация сахара в момент t; k - эффективная константа скорости реакции. [60]
Страницы: 1 2 3 4 5