Диаграмма - растворимость
Cтраница 1
Диаграмма растворимости в системе из трех солей и воды может быть построена расчетным путем, если известны ограничивающие ее тройные системы - две соли и вода. [1]
Диаграммы растворимости позволяют не только оценить качественно фазовое состояние системы, но и определить ряд количественных характеристик превращений, протекающих в. [2]
Диаграммы растворимости в системе NaCl - NH4HCO3 - Н2О показывают теоретическую невозможность полного превращения поваренной соли в осадок бикарбоната натрия. В этом заключается один из главных недостатков аммиачно-содового производства. [3]
Диаграмма растворимости позволила рассчитать процесс сст-ыестного хлорирования двух гидроокисей и определить то лакеи-ыально возможное количество хлористого натрия, которое мо но отделить в процессе хлорирования и получить раствор, обогащенный гипохлоритом лития. [4]
 |
Изотермы растворимости солей в системе KCI - CaSO - NHa - Н2О. [5] |
Диаграмма растворимости всех изученных изотерм системы как в водных, так и в аммиачных растворах состоят практически из четырех полей кристаллизации: K2SO4, K2SO4 - CaSO4 - H2O, CaSO4 - 2Н2О и КС1, так как поле кристаллизации СаС12 - 6Н2О ничтожно мало. [6]
Диаграмма растворимости позволила рассчитать процесс cci - местного хлорирования двух гидроокисей и определить то лакси-мально возможное количество хлористого натрия, которое молко отделить в процессе хлорирования и получить раствор, ибогауш-ный гипохлоритом лития. [7]
 |
Оптимальный цикл конверсии КС1 NaNO3 KN03 NaCl в диаграмме с изотермическим ( 50 С и изобарическим ( 1 ат сечениями.| Изотермы растворимости в водной системе NH4NO, KC1KN03 NH4C1 при 0 и 100 С. [8] |
Диаграмма растворимости в системе NH4N03 - f - KC1 KN03 - j - NH4C1 ( рис. 144) показывает, что поле кристаллизации KN03 сильно увеличивается при понижении температуры. [9]
Диаграмма растворимости усложняется, если между компонентами системы происходит химическое взаимодействие. В случае системы соль - вода это приводит к возможности существования трех и большего числа твердых фаз, каждой из которых отвечает определенная ветвь кривой растворимости. [10]
Диаграмма растворимости в системе NH4NO3 KC1 - KNO3 NH4C1 ( рис. 91) показывает, что поле кристаллизации KNO3 сильно увеличивается при понижении температуры. Использование этого способа затрудняется необходимостью после выделения KNO3 выпаривать раствор хлористого аммония, интенсивно разрушающий выпарные аппараты; кроме того, потребность в хлористом аммонии относительно невелика. [11]
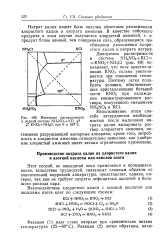 |
Изотермы растворимости в водной системе NH4NO3 KC1 t.. KNO3 - f - NH4Cl при 0 и 100 С. [12] |
Диаграмма растворимости в системе NH4NO3 KC1 KNO3 NH4C1 ( рис. 49) показывает, что поле кристаллизации КМО3 сильно увеличивается при понижении температуры. [13]
Диаграммы растворимости изотермические ( изотермы) 28, 30 ел. [14]
Диаграммы растворимости в системе NaCl-NH COs - НгО показывают теоретическую невозможность полного превращения поваренной соли в осадок бикарбоната натрия. В этом заключается один из главных недостатков аммиачно-содового производства. [15]
Страницы: 1 2 3 4 5