Диаграмма - растворимость
Cтраница 3
Диаграмма растворимости усложняется, если между компонентами системы происходит химическое взаимодействие. [31]
Диаграмма растворимости двухкомпонентной системы позволяет рассчитать относительные количества составляющих системы, в частности количества жидкой и твердой фаз или испаряющейся воды в любой момент изотермического испарения. Для этого пользуются правилом рычага, основой которого является правило соединительной прямой: точка состава системы лежит на одной прямой с фигуративными точками составляющих систему комплексов. Под комплексами в данном случае можно понимать любую комбинацию составных частей системы ( это могут быть фазы или отдельные компоненты, лишь бы система могла быть представлена в виде их смесей. В соответствии с правилом соединительной прямой точка состава системы т0 лежит на одной прямой с точками mt и Я. Соединительные прямые называют также коннодами. [32]
Диаграммы растворимости тройных систем строятся при температурах, когда один или два компонента находятся в жидком состоянии. Заметим также, что изотермами растворимости называются кривые растворимости при постоянной температуре. [33]
Диаграммы растворимости тройных систем классифицируются с учетом числа жидких компонентов ( одного или двух) и характера взаимодействия их: отсутствия химического взаимодействия, образования твердых растворов, образования химических соединений. Обычно изотермы растворимости тройных систем представляют собой сечения физико-химической фигуры растворимости в области существования жидкой фазы. Так как растворимость в тройной системе изображается поверхностью аналогичной ликвидусу, изотермы растворимости представляют собой кривые, отвечающие равновесному сосуществованию двух фаз. Пересечение ветвей изотермы растворимости, отвечающих сосуществованию в моновариантном равновесии двух фаз, дает нон-вариантные точки. [34]
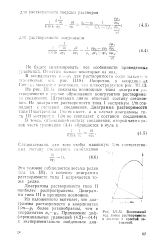 |
Возможный ход линии растворимести в системе с простой эв-тоннкой. [35] |
Диаграммы растворимости типа II наиболее распространены. Диаграмма типа III в принципе возможна. [36]
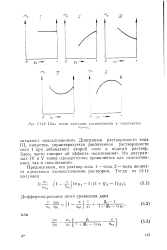 |
Пять типов диаграмм растворимости ь координатах. [37] |
Диаграмма растворимости типа III, напротив, характеризуется увеличением растворимости соли 1 при добавлении второй соли в водный раствор. [38]
Диаграммы растворимости ассоциирующих коллоидов в воде отличаются большим разнообразием. [39]
Чшьные диаграммы растворимости ос-л чются, по сравнению с изображен-нк ta рис. 1, образованием нескольких гид to, а также наличием полиморфных фор етастабильных состояний. [40]
Диаграммы растворимости жидких гетерогенных систем являются, таким образом, фазовыми. На них фиксируются поля газообразных фаз, расположенные выше кривой температуры кипения, поля гомогенных жидких фаз вне контура и двухфазные области внутри контура бинодальной кривой в случае ее замкнутости или между двумя ее ветвями. [41]
Диаграмма растворимости тройной жидкой системы с тремя двухфазными разрывами сплошности известна одного типа. [42]
Диаграмма растворимости четверной взаимной системы с кристаллогидратом на основе двойной соли имеет аналогичное строение. [43]
Диаграмму растворимости двух солей часто строят в прямоугольных координатах. На одной оси откладывают количество граммов ( или молей) одной соли в 100 граммах ( или молях) воды, а на другой оси - количество граммов второй соли на 100 граммов воды. На оси, перпендикулярной первым двум, откладывают температуру. Точке 0 соответствует чистая вода. Чистой соли АХ и ВХ на этом графике соответствуют точки, бесконечно удаленные от начала координат. Процентное содержание солей в системе отсчитывается непосредственно на координатах. [44]
Из диаграммы растворимости Na2S04 в воде ( рис. XII.1) следует, что для насыщенных водных растворов стабильной фазой от - 1 2 ( 4 0 вес. [45]
Страницы: 1 2 3 4 5