Более сложные ассоциат
Cтраница 4
Если средняя степень ассоциации р 1, то концентрация мономерных молекул ROH и димеров ( ROH) 2 в спирте невелика. В этих условиях вполне применимо допущение, что константы равновесия и константы скоростей всех реакций ( VIII. В тех случаях, когда р по порядку величины близко к единице, концентрации мономеров и димеров относительно велики. В этих условиях целесообразно выделять реакцию разрыва Н - связи в димерах, потому что изменение энтропии S системы в ходе этой реакции заметно отличается от изменений S в случае более сложных ассоциатов. [46]
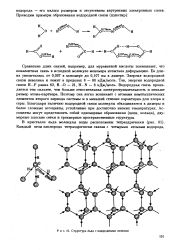 |
Структура льда с водородными связями. [47] |
Энергия водородной связи невелика и лежит в пределах 8 - 80 кДж / моль. Водородная связь проявляется тем сильнее, чем больше относительная электроотрицательность и меньше размер атома-партнера. Поэтому она легко возникает с атомами неметаллических элементов второго периода системы и в меньшей степени характерна для хлора и серы. Благодаря наличию водородной связи молекулы объединяются в димеры и более сложные ассоциаты, устойчивые при достаточно низких температурах. Ас-социаты могут представлять собой одномерные образования ( цепи, кольца), двумерные плоские сетки и трехмерные пространственные структуры. [48]
 |
Структура льда с водородными связями. [49] |
Сравнение длин связей, например, для муравьиной кислоты показывает, что ковалентная связь в исходной молекуле мономера испытала деформацию. Энергия водородной связи невелика и лежит в пределах 8 - 80 кДж / моль. Водородная связь проявляется тем сильнее, чем больше относительная электроотрицательность и меньше размер атома-партнера. Поэтому она легко возникает с атомами неметаллических элементов второго периода системы и в меньшей степени характерна для хлора и серы. Благодаря наличию водородной связи молекулы объединяются в димеры и более сложные ассоциаты, устойчивые при достаточно низких температурах. Ас-социаты могут представлять собой одномерные образования ( цепи, кольца), двумерные плоские сетки и трехмерные пространственные структуры. [50]
Сравнение длин связей, например для муравьиной кислоты, показывает, что ковалентная связь в исходной молекуле мономера испытала деформацию. Большее или меньшее удлинение связи п - X и ее разрыхление наблюдается и в других веществах. Y упрочняет водородную связь. Энергия этой связи примерно в 10 раз больше энергии ван-дер-ваальсбвого взаимодействия и на порядок меньше энергии ковалентной связи. Водородная связь проявляется тем сильнее, чем больше относительная электроотрицательность и меньше размер атома-партнера. Поэтому она легко возникает с атомами неметаллических элементов второго периода Периодической системы и в меньшей степени характерна для хлора и серы. Несмотря на малую прочность водородной Связи, она определяет иногда структуру вещества и существенно влияет на его физические и химические свойства. Благодаря водородным связям молекулы объединяются в димеры и более сложные ассоциаты, устойчивые при достаточно низких температурах. [51]
Страницы: 1 2 3 4