Ассоциация - молекула - растворенное вещество
Cтраница 2
Законы Вант-Гоффа и Рауля справедливы для идеальных растворов, в которых не происходит химическое взаимодействие между компонентами раствора, а также диссоциация или ассоциация молекул растворенного вещества. Однако опыт показывает, что не все растворы подчиняются этим законам. Установлено, что растворы, которые способны проводить электрический ток ( электролиты), имеют более высокое, чем по закону Вант-Гоффа, осмотическое давление. Эти растворы кипят при более высокой температуре и замерзают при более низкой, чем это следует из закона Рауля. Такими свойствами обладают растворы солей, кислот и оснований. [16]
Резкое падение у до весьма низких значений, наблюдаемое для ряда красителей, пуринов и пиримидинов ( табл. 1.14), было объяснено ассоциацией молекул растворенного вещества. [17]
Тем не менее в разбавленных растворах, где число молекул одного из компонентов в десятки раз меньше числа молекул другого, ассоциация с растворителем сильно уменьшает степень ассоциации молекул растворенного вещества между собой. [18]
При изложении раздела Электропроводность растворов необходимо отметить, что законы Вант-Гоффа и Рауля справедливы только для идеальных растворов, в которых не происходит химического взаимодействия между компонентами раствора, а также нет диссоциации или ассоциации молекул растворенного вещества. Опыт показывает, что не все растворы подчиняются этим законам. Установлено, что растворы солей, кислот и оснований, которые способны проводить электрический ток ( так называемые электролиты), имеют более высокое, чем это следует по закону Вант-Гоффа, осмотическое давление, кипят при более высокой и замерзают при более низкой температурах, чем это можно ожидать из закона Рауля. В демонстрационном опыте 20 довольно полно рассматриваются явления электропроводности растворов различных органических и неорганических соединений. [19]
Таким образом, по температурной зависимости спектра поглощения концентрированного раствора, по влиянию природы растворителя, по характеру изменений ультрафиолетовой полосы поглощения, а также по виду изменений свечения при увеличении концентрации раствора всегда можно однозначно установить, имеет ли место в растворе ионизация или ассоциация молекул растворенного вещества. [20]
Растворитель и растворенное вещество связываются между собой водородными мостиками. Ассоциация молекул растворенного вещества в этих условиях большей частью исключается. [21]
В схеме не рассмотрены последние два вида взаимодействия, так как в разбавленных растворах, о которых идет речь, ассоциация молекул растворителя не нарушается, а ассоциаты молекул растворенного вещества под влиянием растворителя полностью диссоциируют на мономерные молекулы. Тем не менее ассоциацию молекул растворенного вещества приходится учитывать при рассмотрении свойств электролитов в апротонных растворителях ( бензол, четыреххлористый углерод), в которых электролиты ( кислоты, основания и соли) ассоциированы и в разбавленных растворах ( см. гл. [22]
В схеме не рассмотрены последние два вида взаимодействия, так как в разбавленных растворах, о которых идет речь, ассоциация молекул растворителя не нарушается, а ассоциаты молекул растворенного вещества под влиянием растворителя полностью диссоциируют на мономерные молекулы. Тем не менее ассоциацию молекул растворенного вещества приходится учитывать при рассмотрении свойств электролитов в апро-тонных растворителях ( бензол, четыреххлористый углерод), в которых электролиты ( кислоты, основания и соли) ассоциированы и в разбавленных растворах ( см. гл. [23]
С другой стороны, значительное снижение энтропии в насыщенных растворах С60 в толуоле при температурах выше ТМР указывает на отсутствие в них эффектов самоассоциации. Известно, что при ассоциации молекул растворенного вещества энтропия раствора увеличивается. Причиной этого является появление дополнительных степеней свободы при движении молекул друг относительно друга в ассоциатах и при тепловом движении ассоциатов в растворе как целого. [24]
 |
Области пропускания призм, растворителей и вазелинового масла ( нуйола, используемых для измерения ИК спектров. Зачернены области полного поглощения, заштрихованы области частичного поглощения. [25] |
Такие спектры могут различаться положением полос поглощения и их интенсивностью. Основной причиной этого может быть ассоциация молекул растворенного вещества с молекулами растворителя и, в частности, образование межмолекулярных водородных связей. [26]
Когда были установлены случаи аномально высоких или аномально низких значений осмотических давлений растворов некоторых веществ, эти явления первоначально были расойотрены. Однако, учитывая явления диссоциации или ассоциации молекул растворенного вещества, необходимо признать, что указанные отступления от закона Вант-Гоффа лишь кажущиеся. Этот закон вою основную сущность ( зависимость осмотического давления от частичной концентрации растворенного вещества) сохраняет в равной степени как для неэлектролитов, так и для электролитов в разбавленных водных растворах и в других средах. [27]
Приведенное уравнение строго справедливо лишь для бесконечно разбавленных растворов при условии, что кристаллизующаяся фаза представляет собой чистый растворитель. Они вызваны двумя причинами - диссоциацией или ассоциацией молекул растворенного вещества и неравенством сил взаимодействия между различного рода частицами. [28]
Мы можем теперь сказать с известной уверенностью, что свободная энергия растворения зависит от двух факторов: 1) эффекта концентрации и 2) эффекта ассоциации. Последний эффект в свою очередь можно далее подразделить на 2а) ассоциацию молекул растворенного вещества друг с другом, 26) ассоциацию молекул растворителя друг с другом и 2в) ассоциацию молекул растворенного вещества с молекулами растворителя. Немало было сделано попыток индивидуализировать каждый из этих четырех эффектов. Для наших же надобностей будет вполне достаточно признать, что, работая в разбавленных растворах, можно уменьшить влияние фактора 2а почти до нуля, а фактор 26 можно считать практически постоянной величиной при работе только с одним растворителем. [29]
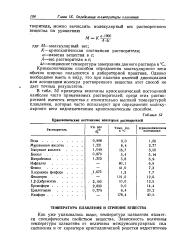 |
Криоскопические постоянные некоторых растворителей. [30] |
Страницы: 1 2 3 4