Астраханит
Cтраница 3
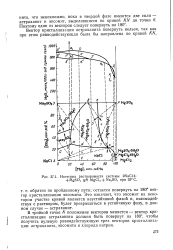
Область существования вантгоффита может расширяться, захватывая часть областей астраханита, а при более высокой температуре - левеита, что в ряде случаев используют на практике. Выше 175 С фаза тенардита исчезает и сульфат натрия существует только в виде двойных солей. В табл. III.6 приведены характеристики жидких и твердых фаз в нонвариантных точках. [31]
 |
Политерма растворимости в солевой системе Na2S04 - MgS04 - H2O. [32] |
В интервале 20 8 - 63 С доминирующее положение занимает астраханит. Дальнейшее повышение температуры сопровождается потерей кристаллической фазой части воды. С одной стороны, это приводит к появлению фазы левеита, а с другой - к полной перестройке двойной соли в кристаллическую фазу вантгоффита, не содержащего кристаллизационной воды. Присутствие сульфата магния в системе оказывает влияние на кристаллические фазы сульфата натрия, приводя к появлению безводной формы при более низкой температуре. [33]
Изменение направления вектора кристаллизации астраханита на 180 означает, что астраханит в данном случае является неустойчивой фазой. Пока имеются соответствующие твердые фазы, фигуративная точка жидкой фазы должна оставаться в точке N. После растворения астраханита состав раствора будет изменяться по кривой N0 в направлении тройной точки О. [34]
В тройной точке N положение векторов меняется - вектор кристаллизации астраханита должен быть повернут на 180, чтобы получить нулевую равнодействующую трех векторов кристаллизации: астраханита, эпсомита и хлористого натрия, так0как в тройной точке 7V состав раствора не изменяется, пока имеются соответствующие твердые фазы и фигуративная точка жидкой фазы должна остаться в точке N. [35]
По наблюдениям В. И. Николаева и Д. И. Кузнецова [45], из лересыщенного раствора астраханита на первых порах выделяется метастабильный NaCl, который затем очень медленно превращается в астраханит. Их лабораторные данные по изменению состава твердой фазы при медленном испарении при 25 С раствора, лежащего в поле кристаллизации астраханита, представлены на рис. IX.14. Те же авторы отмечают, что в 15 образцах астраханита, взятых в разное время и из разных астраханских озер, содержание NaCl менялось от 72 81 до 0 48 вес. [36]
 |
Изотерма растворимости системы 2NaCl MgSO4 5 MgCl2 Na2SO4 при 25 С. [37] |
В тройной точке N положение векторов меняется - вектор кристаллизации астраханита должен быть повернут на 180, чтобы получить нулевую равнодействующую трех векторов кристаллизации: астраханита, эпсомита и хлорида натрия. [38]
Николаев и Коган [65], изучая скорости растворения закрепленных кристаллов астраханита в воде при 330 оборотах мешалки в 1 мин. [39]
В тройной точке N положение векторов меняется - вектор кристаллизации астраханита должен быть повернут на 180, чтобы получить нулевую равнодействующую трех векторов кристаллизации: астраханита, эпсомита и хлористого натрия, так как в тройной точке N состав раствора не изменяется, пока имеются соответствующие твердые фазы и фигуративная точка жидкой фазы должна остаться в точке N. [40]
 |
Взаимная система. [41] |
В тройной точке W положение векторов меняется - вектор кристаллизации астраханита должен быть повернут на 180, чтобы получить нулевую равнодействующую трех векторов кристаллизации: астраханита, эпсомита и хлористого натрия. [42]
На поверхности GP2P3 лежат фигуративные точки растворов, из которых кристаллизуется астраханит, как вторая соль. Поверхность GPSP4 - геометрическое место точек растворов, из которых второй солью кристаллизуется эпсомит. Из растворов состава ОР Рс, в качестве второй соли твердую фазу кристаллизуется сакиит, а из растворов GPsP6 - тетра-гидрат сульфата магния. [43]
Для переработки современных отложений Кара-Богаз - Гола, содержащих галит, астраханит и эпсомит, на сульфат натрия во ВНИИГе были предложены два технических решения: 1) растворение в морской воде смеси солей на месте их залегания путем создания на территории Куркузульской бухты малого Кара-Богаз - Гола с последующим использованием существующего бассейнового хозяйства; 2) растворение измельченной соляной породы в заводских аппаратах с последующим охлаждением сульфатных растворов с помощью искусственного холода. [44]
Двойная соль магния и натрия MgSO4 Na2SO4 4Н2О встречается в виде астраханита ( озера и дельта Волги и Аральское море); в настоящее время находит применение в химической пром-сти. [45]
Страницы: 1 2 3 4