Коррозия - ниобий
Cтраница 1
Коррозия ниобия в жидком натрии при 600 составляет не более 0 025 мм в год. [1]
Коррозия ниобия в жидком натрии при 600 составляет не более 0 026 мм в год. [2]
В концентриров анной соляной кислоте скорость коррозии ниобия составляет уже - 0 5 г / м 2-час. [3]
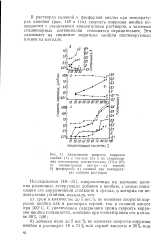
В растворах соляной и фосфорной кислот при температурах Кипения ( рис. Пб и Не) скорость коррозии ниобия повышается с увеличением концентрации растворов, а значения стационарных потенциалов становятся отрицательнее. Это указывает на снижение защитных свойств пассивирующих пленок на металле. [5]
В узкой области потенциалов, расположенной между 0 2 и 0 4 в, на анодных кривых 1 - 5 ниобия значения плотности тока несколько ниже ( примерно на порядок), чем в остальной области потенциалов, что, вероятно, связано с одновременно идущим деполяризующим катодным процессом, возможно восстановлением кислорода. Коррозия ниобия в 94 % - ном растворе серной кислоты при 100 С вплоть до потенциала 0 2 в отсутствует. При потенциалах 0 2 в скорость коррозии начинает возрастать, достигая максимума ( 450 г / л2 - час) при 0 5 в, а затем снижается, но даже в пределах значений от 1 4 до 2 2 в скорость коррозии довольно высокая, порядка 80 - 90 г / м2 - час. [6]
Границы применения сплавов в сильно агрессивных средах расширяются при увеличении в сплаве тантала. Скорость коррозии ниобия в кипящих растворах серной, фосфорной и соляной кислот увеличивается с концентрацией. Тантал пассивен в исследованных кислотах и только в серной кислоте при концентрации выше 75 % он разрушается в результате охрупчиваяия. Установлены две области потенциалов, в которых скорость - коррозии ниобия и сплавов в серной и фосфорной кислотах увеличивается. При потенциалах, близких к стационарным, увеличение скорости коррозии связано с разрушением несовершенной пер вичной окисной пленки. В области более высоких положительных потенциалов усиление анодного процесса происходит в результате растворения солевых пленок. В соляной кислоте скорость коррозии не зависит от потенциала. В условиях опыта близкие значения скоростей коррозии ниобия, полученные из весовых потерь и рассчитанные по току, свидетельствуют о его переходе в раствор в пятивалентном состоянии в широкой области положительных потенциалов. [7]
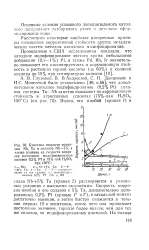 |
Кинетика скорости коррозии Nb, Та и сплавов Nb-Та, а также влияние на скорости коррозии катодного модифицирования сплавов 0 2 % Pt в 75 % - ной H2SO4 при 150 С. [8] |
Та ( кривая 2) растворяются в указанных условиях с высокими скоростями. Скорость коррозии ниобия и его сплавов с 5 % Та, дополнительно легированных 0 2 % Pt ( кривые / и 2), в начальный момент достаточно высокая, а затем быстро снижается в течение первых 10 ч испытания, после чего она принимает постоянное значение, гораздо более низкое, чем для тех же сплавов, не модифицированных платиной. [9]
Видно, что ниобий ( кривая /) и сплав ниобия с 5 % тантала ( кривая 2) растворяются в указанных условиях с возрастающими скоростями. Скорость коррозии ниобия и его сплавов с 5 % Та, дополнительно легированных 0 2 Pt ( кривые 1 и 2), в начальный момент достаточно высокая, а затем быстро снижается в течение первых 10 час. На сплавах Nb-30 % Та модифицирование 0 2 Pt дает дальнейшее повышение устойчивости. Сплав Nb-30 % Та-0 2 Pt по своей устойчивости уже приближается к чистому танталу. Механизм положительного влияния платины вполне аналогичен обсужденному выше и определяется также смещением потенциалов коррозии в область устойчивого пассивного состояния сплава Nb-Та при накоплении на поверхности достаточного для этого количества платины. [10]
Увеличение скорости коррозии ниобия и сплавов при потенциалах от 0 до 0 2 в в серной кислоте ( рис. 16а, кривые 1 - 5) и от - 0 2 до 0 в в фосфорной кислоте ( рис. 166, кривые 1 - 6) объясняется разрушением первоначального окисла на их поверхности. В результате дальнейшего смещения потенциала в положительную сторону ниобий и сплавы пассивируются и в определенной области потенциалов имеют наименьшую скорость коррозии, а затем при более положительных потенциалах скорость коррозии их снова увеличивается в результате растворения образовавшихся солевых пленок, состоящих в серной кислоте из оксисульфатов и в фосфорной из оксифосфато в ниобия. [11]
В 88 % - ной фосфорной кислоте ( кривая 2) у ниобия наблюдается две области повышения скорости коррозии. Первая, при потенциалах, близких к стационарному значению, характеризующая активное состояние ниобия. Далее отмечается узкая область, несколько положительнее стационарного значения потенциалов, в которой скорость коррозии ниобия уменьшается благодаря образованию на его поверхности стабильных анодных пленок [61], и затем область более положительных потенциалов ( до 4 0 в), где наблюдается увеличение скорости коррозии ниобия. [12]
В 88 % - ной фосфорной кислоте ( кривая 2) у ниобия наблюдается две области повышения скорости коррозии. Первая, при потенциалах, близких к стационарному значению, характеризующая активное состояние ниобия. Далее отмечается узкая область, несколько положительнее стационарного значения потенциалов, в которой скорость коррозии ниобия уменьшается благодаря образованию на его поверхности стабильных анодных пленок [61], и затем область более положительных потенциалов ( до 4 0 в), где наблюдается увеличение скорости коррозии ниобия. [13]
Щелочные металлы могут взаимодействовать также с кислородом, растворенным в твердом металле. При этом, если свободная энергия образования окисла твердого металла меньше энергии образования окиси щелочного металла, то щелочные металлы отбирают у твердых металлов растворенный в них кислород. В результате этого щелочной металл может проникать по границам зерен твердого металла и также интенсифицировать межкристаллитную коррозию. Такое явление наблюдается, например, при коррозии ниобия в литии, когда последний проникает по границам зерен и образует там окислы ниобия, причем глубина проникновения лития тем больше, чем выше содержание кислорода в ниобии. Известно также, что свободные от кислорода Nb, Та, Ti, Zr, Mo и W плохо растворяются в щелочных металлах. На механические свойства твердых металлов влияет смачивание их жидким металлом даже в отсутствие коррозионного воздействия, В некоторых случаях достаточно пластичный металл после выдержки в жидком металле становится хрупким. Это явление связывают с адсорбционным влиянием среды. Жидкий металл проникает по линиям дислокаций, образующимся на ранних стадиях деформации. Адсорбированные жидкие металлы уменьшают энергетический барьер, препятствующий выходу дислокаций на поверхность и разупрочняющий металл. [14]
Границы применения сплавов в сильно агрессивных средах расширяются при увеличении в сплаве тантала. Скорость коррозии ниобия в кипящих растворах серной, фосфорной и соляной кислот увеличивается с концентрацией. Тантал пассивен в исследованных кислотах и только в серной кислоте при концентрации выше 75 % он разрушается в результате охрупчиваяия. Установлены две области потенциалов, в которых скорость - коррозии ниобия и сплавов в серной и фосфорной кислотах увеличивается. При потенциалах, близких к стационарным, увеличение скорости коррозии связано с разрушением несовершенной пер вичной окисной пленки. В области более высоких положительных потенциалов усиление анодного процесса происходит в результате растворения солевых пленок. В соляной кислоте скорость коррозии не зависит от потенциала. В условиях опыта близкие значения скоростей коррозии ниобия, полученные из весовых потерь и рассчитанные по току, свидетельствуют о его переходе в раствор в пятивалентном состоянии в широкой области положительных потенциалов. [15]
Страницы: 1 2