Коррозия - сталь
Cтраница 2
Коррозия стали в кислотах, протекающая с водородной деполяризацией ( основной катодный процесс - восстановление ионов водорода), идет преимущественно с катодным контролем, поэтому наиболее эффективно замедлять коррозию будут катодные замедлители. В кислых средах они могут увеличивать торможение катодной реакции восстановления иона водорода - повышать перенапряжение водорода ( соли As, Bi, некоторые органические замедлители) и уменьшать площадь действующих катодов путем образования пленки ( органические замедлители), В последнем случае возможно одновременное распространение пленки и на анодные участки; это вызывает увеличение торможения анодного процесса и повышение омического сопротивления системы, что также тормозит коррозионный процесс. [16]
Коррозия стали в различных водах, независимо от их солености и назначения, происходит вследствие электрохимического процесса, сопровождающегося кислородной деполяризацией. [17]
Коррозия стали в щелочных растворах изучена еще недостаточно. [18]
Коррозия стали в воде и водных растворах солей, т.е. в нейтральных средах со значением рН, равным 5 - - 9, происходит в присутствии кислорода; электрохимический процесс коррозии протекает с кислородной деполяризацией. [19]
Коррозия стали и чугуна в парогазовой среде при температуре 60 и 80 С больше, чем в жидкой; причем характер разрушений испытываемых материалов в жидкой среде равномерный, в парогазовой - точечный и язвенный. [20]
Коррозия стали в присутствии ванадия связана с его способностью проявлять переменную валентность. [21]
Коррозия стали в водной среде, содержащей кислород н ионы водорода, испытывает торможение со стороны образующихся продуктов коррозии. [22]
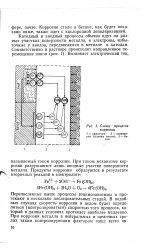 |
Схема процесса коррозии. [23] |
Коррозия стали в бетоне, как будет показано ниже, также идет с кислородной деполяризацией. [24]
Коррозия стали и чугуна в кислотах, являю-гцихся окислителями, представляет собой более сложный процесс, гак как под действием окислителя на поверхности металла может образоваться защитная пленка. [25]
Коррозия стали в водной среде, содержащей кислород и ионы водорода, со временем замедляется. Это происходит, в частности, за счет перехода железа в раствор и повышения рН; при показателе рН 9 6, соответствующем насыщенному раствору Fe ( OH) 2, и полном израсходовании кислорода скорость коррозии практически равна нулю. [26]
Коррозия стали в системе углеводороды-водные растворы на нефтяных и газовых скважинах является электрохимическим процессом и может быть исследована при помощи электрохимических методов по разработанной нами методике. [27]
Коррозия стали Х18Н9Т связана с накоплением в циркулирующей кислоте значительных количеств ионов хлора, который попадает в систему в основном с содовым раствором, подаваемым в башни щелочной абсорбции в виде NaCl. В связи с этим основной задачей является выведение ионов хлора из системы кислой абсорбции. [28]
Коррозии стали не наблвдается. [29]
Коррозия стали объясняется электрохимическими процессами, возникающими в результате воздействия электролитов на неоднородную по химическому составу поверхность стали. В результате неоднородности металла и среды, соприкасающейся с ним, образуются гальванические элементы ( микро - и макропары), имеющие электрический потенциал. Работа этих гальванических элементов, в процессе которой происходит окисление металла, вызывает коррозию арматуры. Скорость коррозии зависит от концентрации кислорода на поверхности стали, рН среды и количества в электролите растворимых солей железа. Наиболее интенсивно ( при прочих равных условиях) коррозия протекает при переменном увлажнении и высушивании бетона. [30]
Страницы: 1 2 3 4