Атака - углеродный атом
Cтраница 1
Атака углеродного атома, например пиридином, начинается с образования ионной диполь-дипольной связи, что облегчает разрыв первоначальной ковалентной связи. Ионная сольвата-ционная связь с углеродом образуется немедленно и затем постепенно переходит в ковалентную. Количественное различие в скорости этого перехода может привести к появлению промежуточной карбониевой соли, имеющей в случае метилгалоге-нида четыре почти чисто ковалентные связи с очень небольшим положительным зарядом на атоме углерода, в то время как в случае третичных галогенных соединений карбониевый ион, имеющий в основном две ионные связи, является относительно свободным и долгоживущим. В случае третичных соединений галогенов реагент, сольватирующий углерод, или растворитель не оказывается ковалентносвязанным ни в лимитирующей стадии, ни в стадии образования продуктов. [1]
В результате этого атака углеродного атома нуклеофильным реагентом, например гидроксил-ионом, облегчается. [2]
В лимитирующей стадии атака углеродного атома может быть трех типов. В случае первичных галогенных соединений возникает ковалентная связь. Для третичных алкилгалогенидов при сольватации образуются главным образом ионные или ион-дипольные связи. Атаке может подвергаться даже не тот углеродный атом, у которого происходит замещение, а другой, как например в случае неопентилхлорида. [3]
В результате этого атака углеродного атома нуклеофильным реагентом, например гидроксил-ионом, облегчается. [4]
Раскрытие эпоксидного кольца происходит главным образом путем атаки углеродного атома со стороны, противоположной эпоксидному кислороду. Некоторые реакции прямого окисления приводят к цис-гидроксилированию двойной связи. [5]
Были изучены различные изомерные структуры протонирован-ного пропана, образующиеся при атаке вторичного углеродного атома протоном. [6]
Действительно, общий основной катализ осуществляется через отрыв протона, тогда как нуклеофильный - через атаку углеродного атома. Ясно, что стерические требования, предъявляемые к реагентам, в первом случае являются менее строгими, чем во втором. Стерические затруднения в нуклеофилъном катализе особенно наглядно можно проиллюстрировать на примере катализируемого пиридином гидролиза уксусного ангидрида: если пиридин является эффективным катализатором этой реакции то такие соединения, как 2-пиколин ( 2-метилпиридин), 2 6-лу-тидин ( 2 6-диметилпиридин) и 2 4 6-коллидин ( 2 4 6-триметил-пиридин), вообще не обладают каталитическим действием. Более того, в реакции сольволиза эфиров пирофосфорной кислоты 2 6-лутидин выступает в роли общего основного катализатора. [7]
До сих пор мы рассматривали главным образом простое присоединение нуклеофилов к самому дегидробензолу, при котором атака любого углеродного атома дегидросвязи приводит к одинаковым продуктам. [8]
В атаке углеродного атома в гораздо большей степени, чем при протонировании аминов, играют роль стерические факторы. Это положение хорошо иллюстрируется при сравнении реакционной способности вторичных и третичных аминов. Несмотря на то, что электронная плотность неподеленных электронов в случае третичных аминов больше, чем у вторичных, порядок реакционной способности обратный. [9]
В атаке углеродного атома в гораздо большей степени, чем при протонировании аминов, играют роль стерические факторы. Это положение хорошо иллюстрируется при сравнении реакционной способности вторичных и третичных аминов. Несмотря на то, что электронная плотность неподеленных электронов в случае третичных аминов больше, чем у вторичных, порядок реакционной способности обратный. [10]
В отличие от 5д 2-замещения у насыщенного атома углерода, которое идет в одну стадию ( синхронный разрыв и образование связи), эти реакции обычно рассматривались на основе представлений о промежуточном комплексе, образованном присоединением нуклеофила к атому углерода, связанному с замещаемой группой. В результате такого присоединения заместители у подвергшегося атаке углеродного атома располагаются в вершинах тетраэдра. [11]
По данным Свэна, эта реакция кинетически третьего порядка. Из этого следует, что наряду с атакой углеродного атома СН3Вг происходит атака галоида. [12]
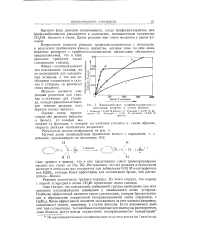 |
Взаимодействие, трифенилхлорметана с метиловым спиртом в сухом бензоле. [13] |
Реакция кинетически третьего порядка. Из этого следует, что наряду с атакой углеродного атома СН3Вг происходит атака галоида. [14]
Наиболее характерная особенность производных трехвалентного фосфора заключается в их способности использовать неподеленную пару электронов фосфора для образования связей с другими атомами. В этом отношении фосфины напоминают амины: они представляют собой слабоосновные соединения, дающие с протонными кислотами фосфониевые соли, а с кислотами Льюиса - аддукты; они выступают также в качестве нуклеофильных агентов, образуя фосфониевые соли в результате атаки углеродного атома алкилгалогенида. [15]
Страницы: 1 2