Внутримолекулярная нуклеофильная атака
Cтраница 1
Внутримолекулярная нуклеофильная атака амидной группой играет важную роль в процессах рацемизации оптически актив. Рацемизация аниона, таким образом, протекает весьма легко. Образование оисазоло-чов было доказано различными методами и является важнейшим маршрутом рацемизации аминокислот. [1]
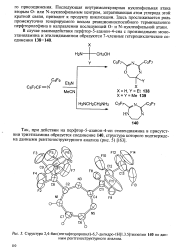 |
Структура 2 4-бис ( гептафторпропил-6 7-дигидро - 1Н тиазепин 140 по данным рентгеноструктурного анализа. [2] |
Последующая внутримолекулярная нуклеофильная атака вторым О - или N-нуклеофильным центром, затрагивающая атом углерода этой кратной связи, приводит к продукту циклизации. Здесь прослеживается роль промежуточно генерируемого весьма реакционноспособного терминального перфторолефина в направлении последующей О - и N-нуклеофильной атаки. [3]
Своеобразным вариантом внутримолекулярной нуклеофильной атаки иона меркуриния являются циклизации с участием двойной связи. [4]
Сохранение конфигурации при этом рассматривается как следствие внутримолекулярной нуклеофильной атаки с образованием промежуточного бромониевого иона. По этому механизму инверсия происходит у С ] как при образовании трехчленного цикла, так и при последующем его раскрытии. В итоге абсолютная конфигурация остается неизмененной. [5]
Напротив, при обработке основанием 2 7-октандиона внутримолекулярную нуклеофильную атаку одной из карбонильных групп осуществляет лишь углеродный атом ионизированной метиленовой группы. [6]
Для всех соседних групп, перечисленных в предыдущем разделе, внутримолекулярная нуклеофильная атака осуществляется атомом, несущим неподеленную пару электронов. [7]
Выход соединения ( 33) соответствует доле реакции, протекающей путем внутримолекулярной нуклеофильной атаки. [8]
По поводу конечной стадии этих реакционных последовательностей важно отметить, что внутримолекулярная нуклеофильная атака по амиднои ipynne происходит по месту наибольшей нуклеофильной реакционной способности - по атому кислорода, а не но азоту. Это общее свойство амидов является результатом относительно высокой электронной плотности на атоме кислорода. [9]
Реакция протекает через промежуточное образование О-аниона, который вступает в реакцию внутримолекулярной нуклеофильной атаки О-нуклеофильного центра по диф-торметиленовой группе. [10]
Элиминирование может также начинаться катионоидным отрывом с освобождением карбаниона, который затем стабилизуется путем внутримолекулярной нуклеофильной атаки. Это механизм ElcB, он осуществляется при проведении реакции в щелочной среде в том случае, если в молекуле имеется атом водорода, подвижный вследствие - Е - или - / - эффектов. [11]
В ряде случаев ионы карбония успевают за короткое время своей жизни изомеризоваться в результате внутримолекулярной нуклеофильной атаки положительно заряженного атома углерода. В качестве центров нуклеофильности при этом выступают алкильные или ариль-ные заместители, расположенные в а-положении к карбониевому атому углерода. В итоге меняют свое положение как заместители, так и положительно заряженный атом углерода. Процесс внутримолекулярного изменения положения заместителя называется миграцией. [12]
Когда X м - С1, то только 12 % общей реакции проходит благодаря внутримолекулярной нуклеофильной атаке. Наконец, при X n - NO2 ( самый сильный электроноакцепторный заместитель), только 1 % всей реакции протекает путем такой атаки. [13]
Гидридная подвижность водорода в альдегидах в реакции Канниццаро, так же как в алкоголятах алюминия в реакции Меервейна - Пондорфа - Верлея, очевидно есть следствие внутримолекулярной нуклеофильной атаки отрицательно заряженного атома кислорода на углерод. В результате гидридная подвижность водорода у атома углерода настолько возрастает, что гидрид-ион переходит даже к такому слабому акцептору, как карбонильная группа второй молекулы альдегида. [14]
Рассмотренные синтезы 2-аминотиофенов основаны на внутримолекулярном присоединении меркаптогруппы к нитрнльной группе. Известно также о получении 2-аминотиофенов путем внутримолекулярной нуклеофильной атаки диалкилсульфидной группы на нитрильную группу. [15]
Страницы: 1 2